Perbedaan antara Homo dan Lumo
Itu perbedaan utama Antara Homo dan Lumo adalah bahwa Homo menyumbangkan elektron sedangkan lumo menerima elektron.
Istilah Homo dan Lumo berada di bawah "teori orbital molekul" subtopik dalam kimia umum. Istilah homo adalah singkatan dari "orbital molekul tertinggi" sedangkan istilah lumo singkatan dari "orbital molekul terendah yang tidak dihuni". Kami menyebutnya "orbital perbatasan". Orbital molekuler memberikan lokasi elektron yang paling mungkin terjadi dalam sebuah atom. Orbital molekuler terbentuk dari kombinasi orbital atom dari dua atom terpisah untuk berbagi elektronnya. Berbagi elektron ini membentuk ikatan kovalen antara atom. Saat membentuk orbital molekuler ini, mereka dibagi menjadi dua bentuk sebagai homo dan lumo.
ISI
1. Ikhtisar dan Perbedaan Utama
2. APA ITU HOMO
3. Apa itu Lumo
4. Perbandingan berdampingan - Homo vs Lumo dalam bentuk tabel
5. Ringkasan
APA ITU HOMO?
Homo adalah singkatan dari orbital molekul tertinggi. Elektron dalam orbital molekul ini dapat disumbangkan ke orbital molekul tipe lumo. Ini karena orbital molekul ini mengandung elektron yang terpasang lemah. Orbital molekul ini adalah bentuk yang paling tersedia untuk ikatan kimia kovalen. Kehadiran orbital molekul ini adalah karakteristik untuk zat nukleofilik.
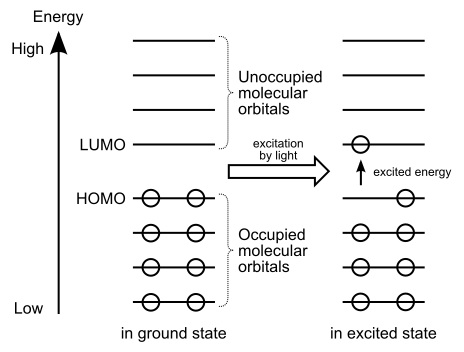
Homo memiliki energi rendah. Oleh karena itu, elektron cenderung berlaku di orbital molekul ini; Karena elektron mencoba mengisi tingkat energi yang rendah terlebih dahulu. Inilah sebabnya kami menyebutnya "orbital yang ditempati". Selain itu, dengan adanya cahaya, rangsangan elektron dapat menyumbangkan elektron dari homo ke lumo.
Apa itu Lumo?
Lumo adalah singkatan dari orbital molekul terendah. Orbital molekuler ini dapat menerima elektron dari homo. Seperti namanya, orbital ini tidak dihuni; Dengan demikian, tidak mengandung elektron. Ini karena energi orbital ini sangat tinggi dan elektron cenderung menempati tingkat energi yang rendah terlebih dahulu. Selain itu, orbital molekul ini adalah karakteristik untuk zat elektrofilik.

Gambar 01: Transfer elektron dari homo ke lumo
Selain itu, jika kami memberikan energi ringan, elektron homo bisa bersemangat dan pindah ke lumo. Itu sebabnya kami mengatakan bahwa Lumo dapat menerima elektron.
Apa perbedaan antara homo dan lumo?
HOMO adalah singkatan dari orbital molekul tertinggi yang ditempati sedangkan istilah lumo adalah singkatan dari orbital molekul terendah yang tidak dihuni. Kedua bentuk orbital ini penting dalam ikatan kimia kovalen, terutama dalam pembentukan ikatan PI. Sebagai perbedaan utama antara Homo dan Lumo, kita dapat mengatakan bahwa homo dapat menyumbangkan elektron sedangkan lumo dapat menerima elektron. Selain itu, keberadaan homo adalah karakteristik untuk nukleofil sedangkan keberadaan lumo adalah karakteristik untuk elektrofil.
Infografis di bawah ini menyajikan rincian lebih lanjut tentang perbedaan antara Homo dan Lumo.
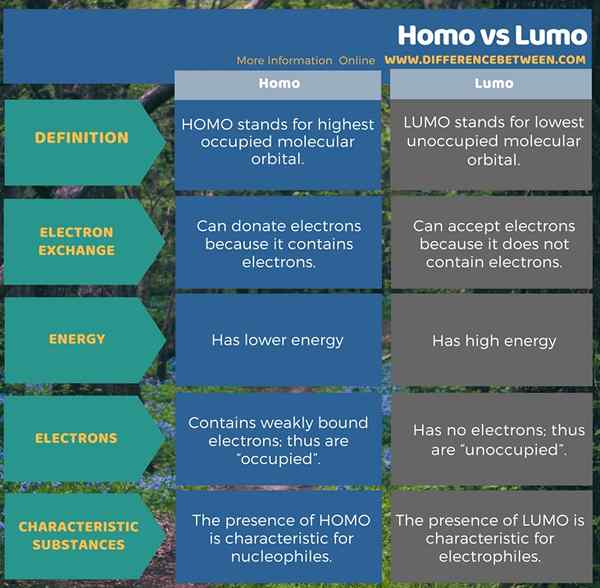
Ringkasan -Homo vs Lumo
Teori orbital molekul perbatasan menjelaskan pembentukan orbital molekul tipe homo dan lumo. Meskipun ada beberapa perbedaan antara kedua jenis ini, perbedaan utama antara HOMO dan LUMO adalah bahwa Homo menyumbangkan elektron sedangkan Lumo menerima elektron.
Referensi:
1. Berburu, Ian R. “Bab 10: Pengantar Teori Mo.”Bab 13 - Dasar NMR. Tersedia disini
2. “Pengantar Teori Orbital Molekuler.Indikator Acid_Base, Henry Rzepa. Tersedia disini
Gambar milik:
1."Diagram Homo-Lumo Molekul" oleh TomGally (Domain Publik) Via Commons Wikimedia


