Perbedaan antara keseimbangan homogen dan heterogen
Itu perbedaan utama antara keseimbangan homogen dan heterogen adalah itu Dalam keseimbangan homogen, reaktan dan produk berada dalam fase materi yang sama sedangkan, dalam keseimbangan heterogen, reaktan dan produk dalam fase yang berbeda.
Keseimbangan adalah keadaan di mana konsentrasi reaktan dan produk tetap konstan. Ada dua jenis keseimbangan sebagai keseimbangan homogen dan keseimbangan heterogen. Kedua jenis ini berbeda satu sama lain sesuai dengan fase materi reaktan dan produk dalam keseimbangan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu keseimbangan homogen
3. Apa keseimbangan heterogen
4. Perbandingan berdampingan - vs homogen. Keseimbangan heterogen dalam bentuk tabel
5. Ringkasan
Apa itu keseimbangan homogen?
Keseimbangan homogen adalah keadaan di mana reaktan dan produk berada dalam fase materi yang sama. Biasanya, reaktan dan produk dalam satu solusi. Kami menyebut jenis campuran reaksi ini sebagai campuran homogen. Spesies kimia yang ada dalam campuran ini dapat berupa molekul, ion, atau kombinasi molekul dan ion. Selain itu, ekspresi untuk konstanta kesetimbangan jenis reaksi ini termasuk konsentrasi semua reaktan dan produk. Misalnya, mencampur gas sulfur dioksida dan gas oksigen memberikan gas sulfur trioksida, semua reaktan dan produk berada dalam fase gas. Maka reaksi dan konstanta keseimbangan (k) adalah sebagai berikut:
2so2 (g) + HAI2 (g) ⇌ 2so3 (g)
K = [jadi3 (g)]2/[JADI2 (g)]2[HAI2 (g)]

Apa keseimbangan heterogen?
Keseimbangan heterogen adalah keadaan di mana reaktan dan produk dalam fase yang berbeda. Di sana fase dapat berupa kombinasi fase padat, cair, dan gas. Namun, tidak seperti keseimbangan homogen, saat menulis konstanta keseimbangan untuk keseimbangan heterogen, kita harus mengecualikan konsentrasi padatan dan cairan murni. Misalnya, mencampur karbon dalam bentuk padat dengan gas oksigen memberikan gas karbon monoksida. Maka reaksi dan konstanta keseimbangan (k) adalah sebagai berikut:
O2(G) + 2c(S) ⇌ 2co(G)
K = [co(G)]2/[HAI2 (g)]
Apa perbedaan antara keseimbangan homogen dan heterogen?
Keseimbangan adalah keadaan di mana konsentrasi reaktan dan produk tetap konstan. Ada dua jenis keseimbangan sebagai keseimbangan homogen dan keseimbangan heterogen. Perbedaan utama antara keseimbangan homogen dan heterogen adalah bahwa dalam keseimbangan homogen, reaktan dan produk berada dalam fase materi yang sama sedangkan, dalam keseimbangan heterogen, reaktan dan produk berada dalam fase yang berbeda.
Selain itu, ketika menentukan konstanta keseimbangan untuk keseimbangan homogen, kita harus memasukkan konsentrasi semua reaktan dan produk; Namun, ketika menentukan keseimbangan heterogen, kita harus mengecualikan konsentrasi padatan dan cairan murni dan perlu menggunakan konsentrasi reaktan dan produk lain. Sebagai contoh, 2so2 (g) + HAI2 (g) ⇌ 2so3 (g) adalah keseimbangan yang homogen dan o2 (g) + 2c(S) ⇌ 2co(G) adalah contoh untuk keseimbangan yang heterogen.
Di bawah infografis tabulasi perbedaan antara keseimbangan homogen dan heterogen.
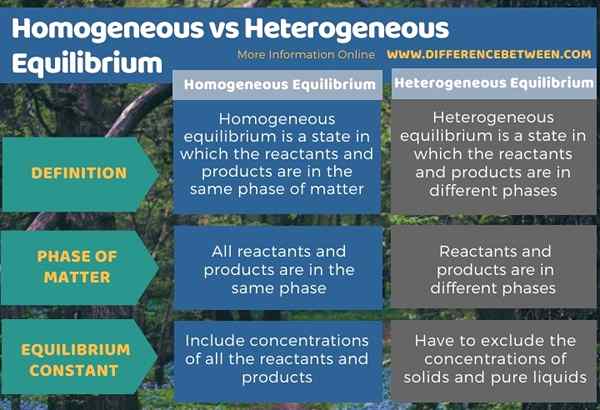
Ringkasan -VS Homogen. Keseimbangan heterogen
Keseimbangan adalah keadaan di mana konsentrasi reaktan dan produk tetap konstan. Ada dua jenis keseimbangan sebagai keseimbangan homogen dan keseimbangan heterogen. Perbedaan utama antara keseimbangan homogen dan heterogen adalah bahwa dalam keseimbangan homogen, reaktan dan produk berada dalam fase materi yang sama sedangkan, dalam keseimbangan heterogen, reaktan dan produk berada dalam fase yang berbeda. Selain itu, konstanta keseimbangan untuk keseimbangan homogen mencakup konsentrasi semua reaktan dan produk, sedangkan konstanta keseimbangan untuk keseimbangan heterogen harus mengecualikan konsentrasi padatan dan cairan murni.
Referensi:
1.“Apa reaksi keseimbangan yang homogen dan heterogen”. Belajar.com, belajar.com, tersedia di sini.
2.“15.4: Keseimbangan heterogen.”Libretexts Chemistry, Libretexts, 18 September. 2019, tersedia di sini.
3. “Keseimbangan larutan heterogen versus heterogen.“Biologi Tanpa Batas. Lumen, tersedia di sini.
Gambar milik:
1. “Campuran dan Zat Murni 2 × 2” oleh John Trombley - Karya Sendiri (CC oleh 4.0) Via Commons Wikimedia


