Perbedaan antara ikatan hidrogen dan ikatan ionik
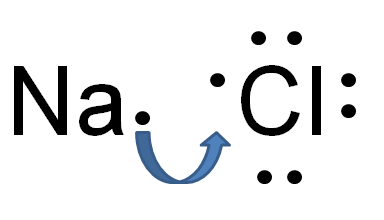
Itu perbedaan utama Antara ikatan hidrogen dan ikatan ionik Ikatan ionik itu ada antara anion permanen dan kation, sedangkan ikatan hidrogen ada antara muatan negatif positif dan parsial parsial.
Ikatan kimia menyatukan atom dan molekul. Ikatan penting dalam menentukan perilaku kimia dan fisik molekul dan atom. Seperti yang diusulkan oleh ahli kimia Amerika G.N.Lewis, atom stabil ketika mengandung delapan elektron di cangkang valensi mereka. Sebagian besar atom memiliki kurang dari delapan elektron dalam cangkang valensi mereka (kecuali gas mulia dalam kelompok 18 dari tabel periodik); Oleh karena itu, mereka tidak stabil. Atom -atom ini cenderung bereaksi satu sama lain menjadi stabil. Dengan demikian, setiap atom dapat mencapai konfigurasi elektronik gas mulia. Ikatan ionik adalah salah satu ikatan kimia tersebut, yang menghubungkan atom dalam senyawa kimia. Ikatan hidrogen adalah atraksi antar molekul antar molekul.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ikatan hidrogen
3. Apa itu ikatan ionik
4. Perbandingan berdampingan - ikatan hidrogen vs ikatan ionik dalam bentuk tabel
5. Ringkasan
Apa itu ikatan hidrogen?
Saat hidrogen melekat pada atom elektronegatif seperti fluor, oksigen atau nitrogen, itu akan menciptakan ikatan kutub. Karena elektronegativitas, elektron dalam ikatan tertarik pada atom elektronegatif lebih dari pada atom hidrogen. Oleh karena itu, atom hidrogen akan mendapatkan muatan positif parsial, sedangkan atom yang lebih elektronegatif akan mendapatkan muatan negatif parsial. Ketika dua molekul yang memiliki pemisahan muatan ini dekat, gaya tarik naik antara hidrogen dan atom bermuatan negatif. Kami menyebut ikatan hidrogen ini.
Ikatan hidrogen relatif lebih kuat dari interaksi dipol lainnya, dan mereka menentukan perilaku molekuler. Misalnya, molekul air memiliki ikatan hidrogen antarmolekul. Satu molekul air dapat membentuk empat ikatan hidrogen dengan molekul air lain. Karena oksigen memiliki dua pasangan tunggal, ia dapat membentuk dua ikatan hidrogen dengan hidrogen bermuatan positif. Kemudian, kita bisa menyebut kedua molekul air sebagai dimer. Setiap molekul air dapat mengikat dengan empat molekul lain karena kemampuan ikatan hidrogen. Itu menghasilkan titik didih yang lebih tinggi untuk air, meskipun molekul air memiliki berat molekul rendah. Oleh karena itu, energi yang dibutuhkan untuk memecahkan ikatan hidrogen ketika mereka pergi ke fase gas sangat tinggi.
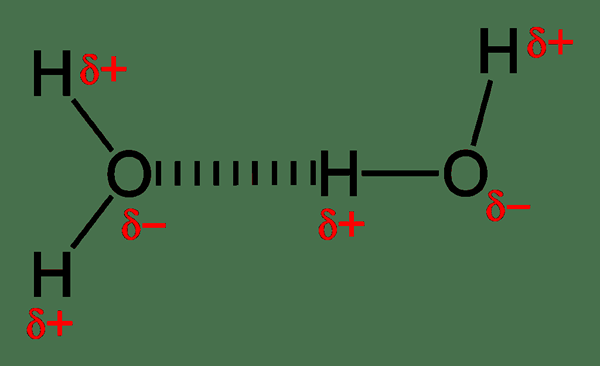
Gambar 01: Ikatan hidrogen antara molekul air
Selanjutnya, ikatan hidrogen menentukan struktur kristal es. Susunan kisi es yang unik membantunya mengapung di atas air; Oleh karena itu, melindungi kehidupan akuatik di periode musim dingin. Selain ini, ikatan hidrogen memainkan peran penting dalam sistem biologis. Struktur tiga dimensi protein dan DNA semata-mata didasarkan pada ikatan hidrogen. Selain itu, ikatan hidrogen dapat dihancurkan dengan kekuatan pemanasan dan mekanik.
Apa itu ikatan ionik?
Atom dapat memperoleh atau kehilangan elektron dan membentuk partikel bermuatan negatif atau positif, masing -masing. Partikel -partikel ini disebut ion. Ada interaksi elektrostatik antara ion. Ikatan ionik adalah kekuatan yang menarik antara ion yang bermuatan berlawanan ini. Kekuatan interaksi elektrostatik sebagian besar dipengaruhi oleh nilai elektronegativitas atom dalam ikatan ionik. Elektronegativitas memberikan pengukuran afinitas atom terhadap elektron. Atom dengan elektronegativitas tinggi dapat menarik elektron dari atom dengan elektronegativitas rendah untuk membentuk ikatan ionik.
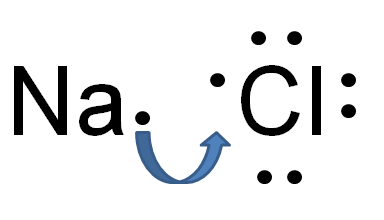
Gambar 02: Pembentukan ikatan ionik dalam natrium klorida
Misalnya, natrium klorida memiliki ikatan ionik antara ion natrium dan ion klorida. Sodium adalah logam; Oleh karena itu, ia memiliki elektronegativitas yang sangat rendah (0.9) dibandingkan dengan klorin (3.0). Karena perbedaan elektronegativitas ini, klorin dapat menarik elektron dari natrium dan membentuk ion Cl- dan Na+. Karena itu, kedua atom mendapatkan konfigurasi elektronik gas yang stabil dan mulia. Cl- dan Na+ disatukan oleh gaya elektrostatik yang sangat kuat, sehingga membentuk ikatan ionik.
Apa perbedaan antara ikatan hidrogen dan ikatan ionik?
Ikatan hidrogen adalah atraksi antar molekul sedangkan ikatan ionik adalah gaya elektrostatik yang menarik. Perbedaan utama antara ikatan hidrogen dan ikatan ionik adalah bahwa ikatan ionik ada antara anion permanen dan kation, sedangkan ikatan hidrogen ada antara muatan negatif positif dan parsial parsial. Selain itu, ikatan ionik lebih kuat dari ikatan hidrogen.
Selain itu, ikatan hidrogen terjadi ketika ada atom hidrogen dan atom elektronegatif sementara ikatan ionik terjadi antara logam dan atom non -logam apa pun. Jadi, ini adalah perbedaan yang signifikan antara ikatan hidrogen dan ikatan ionik. Selain itu, perbedaan lebih lanjut antara ikatan hidrogen dan ikatan ionik adalah bahwa ikatan hidrogen mudah dipecah karena mereka adalah gaya tarik antar molekul atau intramolekul, tetapi ikatan ionik adalah ikatan kimia yang kuat yang sulit dipecahkan.
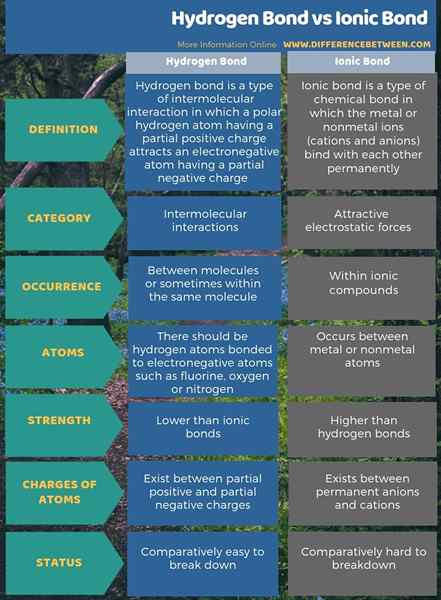
Ringkasan -ikatan hidrogen dan ikatan ionik
Ikatan ionik terjadi dalam senyawa ionik. Ikatan hidrogen adalah ikatan antar-molekul. Perbedaan utama antara ikatan hidrogen dan ikatan ionik adalah bahwa ikatan ionik ada antara anion permanen dan kation, sedangkan ikatan hidrogen ada antara muatan negatif positif dan parsial parsial.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh ikatan hidrogen."Thoughtco, May. 6, 2019, tersedia di sini.
2. Helmenstine, Anne Marie. “Definisi ikatan ionik."Thoughtco, Jan. 26, 2019, tersedia di sini.
Gambar milik:
1. “Hidrogen-Bonding-in-Water-2D” (Domain Publik) via Commons Wikimedia
2. “NaCl Ionic Bond” oleh Mhowison - karya sendiri (domain publik) melalui Commons Wikimedia


