Perbedaan antara hidrogenasi dan pengurangan

Itu perbedaan utama Antara hidrogenasi dan reduksi adalah itu Hidrogenasi membutuhkan katalis sedangkan reduksi tidak memerlukan katalis kecuali hidrogenasi. Hidrogenasi adalah bentuk reaksi reduksi di mana hidrogen molekul bergabung dengan molekul yang ada. Oleh karena itu, hidrogenasi dan reduksi saling berhubungan.
Pengurangan dapat berupa penurunan jumlah oksidasi, hilangnya oksigen atau penambahan hidrogen. Tetapi beberapa reaksi reduksi tidak melibatkan oksigen atau hidrogen sebagai reaktan. Oleh karena itu, definisi pengurangan yang paling dapat diterima adalah penurunan angka oksidasi. Selain perbedaan utama di atas, ada beberapa perbedaan lain antara dua reaksi kimia ini seperti komponen reaksi kimia; Molekul yang memiliki ikatan ganda atau tiga dapat mengalami hidrogenasi sementara molekul apa pun yang memiliki atom dengan bilangan oksidasi yang lebih tinggi dapat mengalami reaksi reduksi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu hidrogenasi
3. Apa itu pengurangan
4. Perbandingan Berdampingan - Hidrogenasi vs Pengurangan dalam Bentuk Tabel
5. Ringkasan
Apa itu hidrogenasi?
Hidrogenasi adalah reaksi kimia yang mencakup penambahan hidrogen molekul ke spesies kimia. Selain itu, reaksi ini biasanya terjadi di hadapan katalis; nikel, paladium, platinum atau oksida mereka. Sangat membantu untuk mengurangi atau memenuhi senyawa kimia. Hidrogenasi dapat mempengaruhi molekul dalam dua cara;
- Saturasi senyawa yang mengandung ikatan ganda atau tiga
- Disosiasi molekul
Hampir semua senyawa tak jenuh mampu bereaksi dengan hidrogen molekuler.
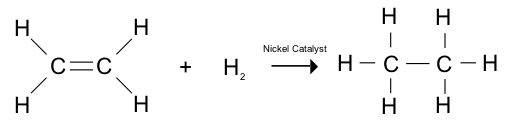
Gambar 01: Hidrogenasi alkena memberikan alkana
Reaksi kimia ini berguna dalam banyak tujuan industri untuk sintesis senyawa yang berbeda seperti hidrogenasi berguna dalam industri perminyakan untuk produksi petrokimia yang berbeda.
Apa itu pengurangan?
Pengurangan adalah penurunan jumlah oksidasi spesies kimia. Reaksi ini adalah setengah reaksi dari reaksi redoks (reaksi redoks memiliki dua reaksi kimia yang terjadi sejajar satu sama lain; oksidasi dan reduksi). Reaksi reduksi mengurangi jumlah oksidasi sementara reaksi oksidasi meningkatkan jumlah oksidasi.
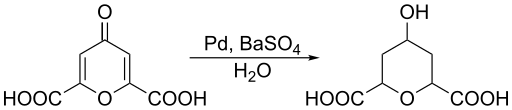
Gambar 02: Pengurangan asam chelidonic
Terkadang, reduksi adalah pengangkatan oksigen atau penambahan hidrogen ke spesies kimia. Selain itu, jenis reaksi ini terjadi dalam tiga cara utama; Kurangi angka oksidasi dari nilai positif ke nilai negatif, dari nol ke nilai negatif atau dari negatif ke nilai negatif lebih lanjut. Contoh umum untuk reaksi reduksi adalah penurunan jumlah oksidasi tembaga (II) menjadi tembaga (0).
Apa perbedaan antara hidrogenasi dan pengurangan?
Hidrogenasi adalah reaksi kimia yang meliputi penambahan hidrogen molekul ke spesies kimia. Pengurangan adalah penurunan jumlah oksidasi spesies kimia. Reaksi hidrogenasi dan reduksi berhubungan satu sama lain karena hidrogenasi adalah bentuk reduksi.
Namun, ada beberapa perbedaan antara dua proses kimia ini seperti yang diberikan di bawah ini. Misalnya, hidrogenasi pada dasarnya membutuhkan katalis untuk perkembangan reaksi sementara reduksi tidak memerlukan katalis kecuali hidrogenasi itu adalah hidrogenasi. Dan juga, hidrogenasi terjadi dengan molekul tak jenuh sementara reduksi terjadi dengan spesies kimia yang memiliki jumlah oksidasi yang lebih tinggi.

Ringkasan -Hidrogenasi vs Pengurangan
Hidrogenasi dan pengurangan adalah reaksi kimia penting yang memiliki banyak aplikasi di industri. Hidrogenasi adalah bentuk reduksi. Perbedaan antara hidrogenasi dan reduksi adalah bahwa hidrogenasi membutuhkan katalis sedangkan reduksi tidak memerlukan katalis kecuali hidrogenasi itu adalah hidrogenasi.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Definisi reduksi dalam kimia."Thoughtco, SEP. 3, 2017. Tersedia disini
2. “Hidrogenasi.”Wikipedia, Wikimedia Foundation, 25 Mei 2018. Tersedia disini
Gambar milik:
1.'Alkene to Alkane'by Robert di Wikibooks Inggris (domain publik) via Commons Wikimedia
2.'Reduksi asam chelidonic'by hbf878 - pekerjaan sendiri, (cc0) via commons wikimedia


