Perbedaan antara hidroksil dan hidroksida
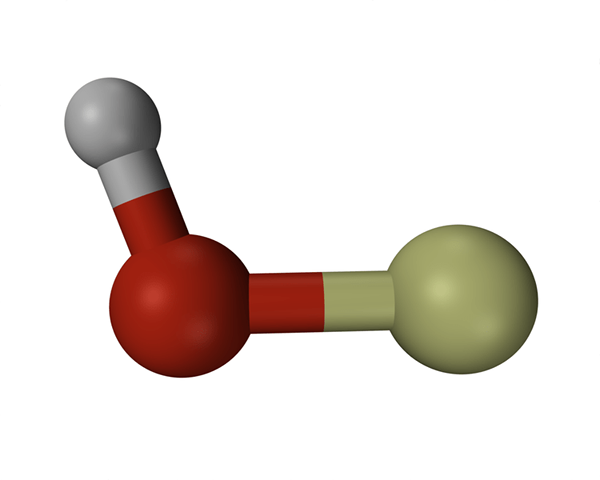
Perbedaan utama - hidroksil vs hidroksida
Dua istilah hidroksil dan hidroksida terdengar sangat mirip karena keduanya memiliki dua atom yang sama, oksigen (O = 16) dan hidrogen (H = 1). Hydroxide adalah ion negatif dengan muatan tunggal dan hidroksil tidak ditemukan dalam bentuk bebasnya, itu adalah bagian dari molekul atau ion lain. Ion hidroksida lebih reaktif daripada gugus hidroksil dalam molekul. Ini adalah perbedaan utama antara hidroksil dan hidroksida.
Apa itu hidroksil?
Hydroxyl adalah senyawa netral dan merupakan senyawa hidroksida netral elektrik yang sesuai. Bentuk bebas hidroksil (• ho) adalah radikal dan ketika terikat secara kovalen ke molekul lain, ia dilambangkan sebagai gugus hidroksil (-oh). Kelompok hidroksil dapat bertindak sebagai nukleofil dan radikal hidroksil digunakan sebagai katalis dalam kimia organik. Kelompok hidroksil tidak terlalu reaktif seperti nukleofil lainnya. Namun, mereka adalah fasilitator dalam pembentukan kekuatan intramolekul yang kuat yang disebut 'ikatan hidrogen'.
Apa itu hidroksida?
Hydroxide adalah anion diatomik yang mengandung atom oksigen dan atom hidrogen. Ikatan antara oksigen dan atom hidrogen adalah kovalen dan formula kimianya oh-. Dialionisasi air menghasilkan ion hidroksil dan oleh karena itu ion hidroksil adalah bagian alami dalam air. Ion hidroksida digunakan sebagai basis, ligan, nukleofil dan katalis dalam reaksi kimia. Selain itu, ion hidrogen menghasilkan garam dengan kation logam dan sebagian besar dari mereka terdisosiasi dalam larutan berair, melepaskan ion hidroksida terlarut. Banyak zat kimia anorganik mengandung istilah "hidroksida" dalam namanya, tetapi mereka tidak ionik dan mereka adalah senyawa kovalen yang mengandung gugus hidroksil.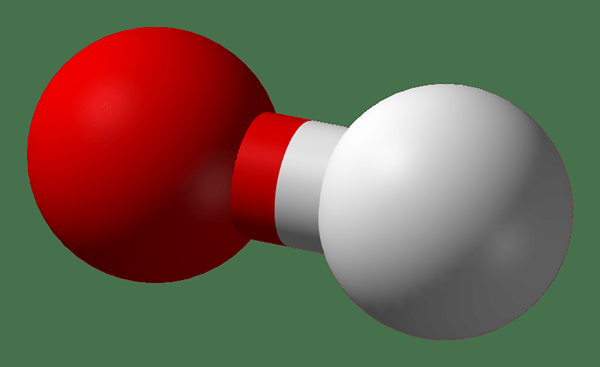
Apa perbedaan antara hidroksil dan hidroksida?
Struktur:
Hydroxyl: Hydroxyl adalah senyawa netral elektrik yang dapat ditemukan dua cara, seperti radikal dan bentuk yang terikat secara kovalen.

Radikal hidroksil saat diikat secara kovalen ke molekul
Hydroxide: Hydroxide adalah ion bermuatan negatif dan muatan negatif pada atom oksigen.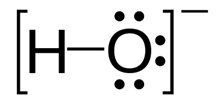 Properti:
Properti:
Hydroxyl: Kelompok hidroksil ditemukan di banyak senyawa organik; Alkohol, asam karboksilat dan gugus hidroksil yang mengandung gula. Senyawa yang mengandung gugus hidroksil seperti air, alkohol, dan asam karboksilat dapat dengan mudah dideprotonasi. Selain itu, gugus hidroksil ini terlibat dalam pembentukan ikatan hidrogen. Ikatan hidrogen membantu molekul untuk tetap bersatu dan ini mengarah pada kepemilikan titik mendidih dan leleh yang lebih tinggi. Secara umum, senyawa organik tidak larut dalam air; Molekul -molekul ini menjadi sedikit larut dalam air ketika mengandung dua atau lebih gugus hidroksil.
Hydroxide:Sebagian besar bahan kimia yang mengandung hidroksida dianggap sangat korosif, dan beberapa sangat berbahaya.Saat bahan kimia ini dilarutkan dalam air, ion hidroksida bertindak sebagai basis yang sangat kuat. Karena ion hidroksida menanggung muatan negatif, itu sering terikat pada ion yang bermuatan positif.
Beberapa senyawa ionik yang mengandung gugus hidroksida dalam molekulnya larut dengan sangat baik dalam air; Basis korosif seperti natrium hidroksida (NaOH) dan kalium hidroksida (KOH) dapat diambil sebagai contoh. Namun, beberapa hidroksida lain yang mengandung senyawa ionik sedikit tidak larut dalam air; Contohnya adalah tembaga (II) hidroksida [Cu (OH)2 - berwarna biru cerah] dan besi (II) hidroksida [Fe (OH)2- cokelat].
Reaktivitas:
Hydroxyl: Kelompok hidroksil kurang reaktif dibandingkan dengan kelompok hidroksida. Tapi, kelompok hidroksil dengan mudah membentuk ikatan hidrogen dan berkontribusi untuk membuat molekul lebih larut dalam air.
Namun, radikal hidroksil sangat reaktif dan sangat berguna dalam reaksi kimia organik.
Hydroxide: Hydroxide (oh-) Kelompok dianggap sebagai nukleofil yang kuat dalam kimia organik.
Referensi: [Email Dilindungi], m. C. (N.D.). Ion hidroksida. Diperoleh 28 Desember 2016, dari sini Ion Hydroxide: Definisi & Formula - Transkrip Video & Pelajaran. (N.D.). Diperoleh 28 Desember 2016, dari sini hidroksida. (N.D.). Diperoleh 28 Desember 2016, dari sini Hydroxy Group. (N.D.). Diperoleh 28 Desember 2016, dari sini kelompok hidroksil: Definisi, Struktur & Formula. (N.D.). Diperoleh 28 Desember 2016, dari sini h. (2014). Apa itu kelompok hidroksil? Diperoleh 28 Desember 2016, dari sini

