Perbedaan antara dipol yang diinduksi dan dipol permanen
Itu perbedaan utama Antara dipol yang diinduksi dan dipol permanen adalah itu Momen dipol yang diinduksi dapat berubah ketika faktor -faktor yang mempengaruhi momen dipol diubah, sedangkan perubahan faktor eksternal tidak mempengaruhi momen dipol permanen.
Kekuatan antarmolekul adalah interaksi antara molekul. Interaksi ini dapat mencakup daya tarik dan tolakan. Gaya antarmolekul yang menarik menyebabkan pembentukan senyawa seperti kristal. Kekuatan antar molekul menarik yang paling umum meliputi ikatan hidrogen, ikatan ionik, interaksi dipol yang diinduksi ion, interaksi dipol ion-permanen, dan gaya van der Waal.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa yang diinduksi dipol
3. Apa itu dipol permanen
4. Perbandingan berdampingan - dipol yang diinduksi vs dipol permanen dalam bentuk tabel
5. Ringkasan
Apa yang diinduksi dipol?
Dipol yang diinduksi mengacu pada momen dipol yang dibuat dalam senyawa nonpolar karena efek ion di dekatnya. Di sini, senyawa ion dan nonpolar membentuk interaksi yang disebut interaksi dipol yang diinduksi ion. Tuduhan ion menginduksi penciptaan dipol (spesies kimia dengan polarisasi). Selain itu, ion dapat mengusir awan elektron senyawa nonpolar dengan semakin dekat dengan senyawa nonpolar.
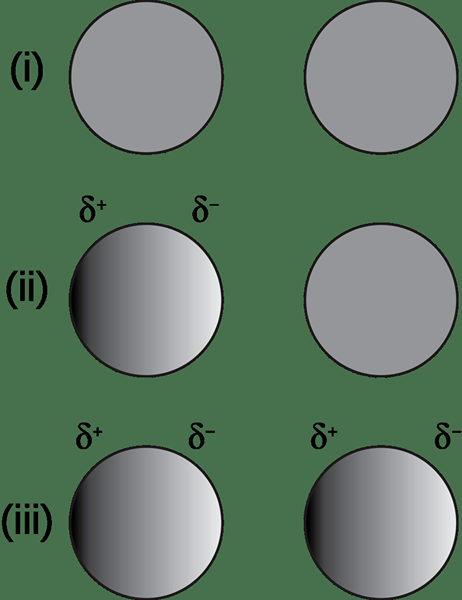
Gambar 01: Pembentukan dipol yang diinduksi di hadapan spesies yang bermuatan
Ion bermuatan negatif dan positif dapat menyebabkan momen dipol jenis ini. Misalnya, mari kita ambil ion bermuatan negatif yang mendorong momen dipol dalam senyawa nonpolar. Sisi senyawa nonpolar yang lebih dekat ke ion mendapat muatan positif parsial karena awan elektron ditolak oleh elektron negatif ion. Ini, pada gilirannya, memberikan sisi lain dari senyawa nonpolar muatan negatif parsial. Oleh karena itu, dipol yang diinduksi dibuat dalam senyawa nonpolar.
Demikian juga, ion muatan positif menarik awan elektron, memberikan muatan negatif parsial ke sisi senyawa nonpolar yang lebih dekat dengan ion positif.
Apa itu dipol permanen?
Dipol permanen mengacu pada momen dipol yang awalnya terjadi pada senyawa karena distribusi elektron yang tidak rata. Oleh karena itu, senyawa kutub mengandung momen dipol permanen.

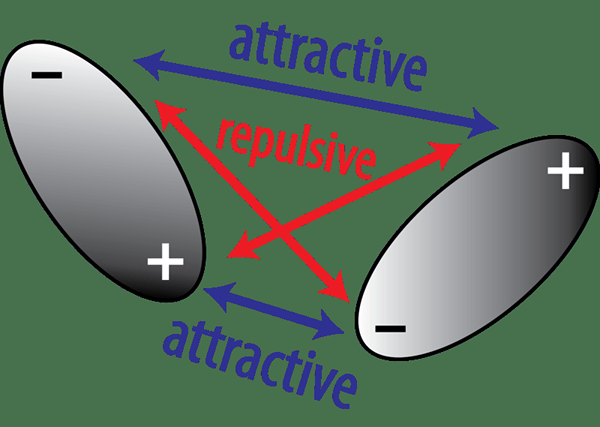
Gambar 02: Daya tarik dan tolakan antara dipol permanen
Di sini, senyawa kutub berisi dua atom yang berbeda dengan nilai elektronegativitas yang berbeda. Karena alasan ini, atom elektronegatif yang lebih dalam senyawa kutub menarik elektron ikatan daripada atom elektronegatif yang lebih sedikit. Ini menciptakan keadaan di mana atom yang lebih elektronegatif mendapatkan muatan negatif parsial sementara atom yang kurang elektronegatif mendapatkan muatan positif parsial. Ini menetapkan dipol permanen dalam molekul.
Apa perbedaan antara dipol yang diinduksi dan dipol permanen?
Dipol yang diinduksi mengacu pada momen dipol yang menciptakan senyawa nonpolar karena efek ion di dekatnya. Sebaliknya, dipol permanen mengacu pada momen dipol yang awalnya terjadi pada senyawa karena distribusi elektron yang tidak rata. Selain itu, diploe yang diinduksi terjadi pada senyawa nonpolar, sedangkan dipol permanen terjadi pada senyawa kutub. Oleh karena itu, perbedaan utama antara dipol yang diinduksi dan dipol permanen adalah bahwa momen dipol yang diinduksi dapat berubah ketika faktor -faktor yang mempengaruhi momen dipol diubah sedangkan faktor eksternal tidak mempengaruhi momen dipol permanen.
Infografis di bawah ini tabulasi perbedaan antara dipol yang diinduksi dan dipol permanen.
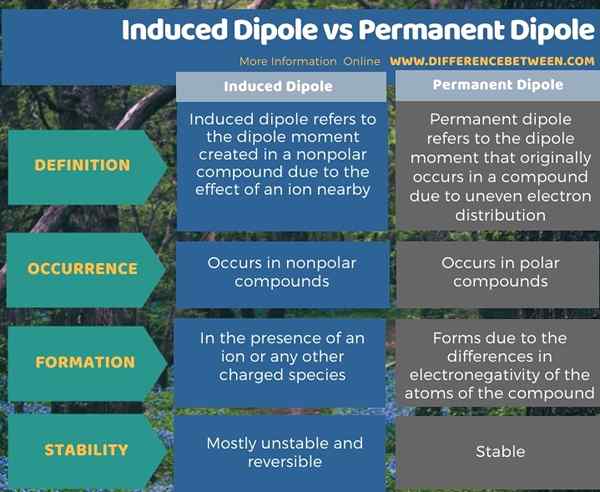
Ringkasan -dipol yang diinduksi vs dipol permanen
Dipol yang diinduksi mengacu pada momen dipol yang menciptakan senyawa nonpolar karena efek ion di dekatnya. Sebaliknya, dipol permanen mengacu pada momen dipol yang awalnya terjadi pada senyawa karena distribusi elektron yang tidak rata. Jadi, perbedaan utama antara dipol yang diinduksi dan dipol permanen adalah bahwa momen dipol yang diinduksi dapat berubah ketika faktor -faktor yang mempengaruhi momen dipol diubah, sedangkan perubahan faktor eksternal tidak mempengaruhi momen dipol permanen.
Referensi:
1.“Interaksi dipol yang diinduksi ion.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
2. “Gaya antarmolekul.”Wikipedia, Wikimedia Foundation, 29 Jan. 2020, tersedia di sini.
Gambar milik:
1. “Skema Interaksi Dipole-Dipole Instan yang Diinduksi” oleh Christopher Rowley-karya sendiri (CC BY-SA 4.0) Via Commons Wikimedia
2. “Skema interaksi elektrostatik antara dua molekul dipolar” oleh Cnrowley - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


