Perbedaan antara yodium dan kalium iodida

Itu perbedaan utama Antara yodium dan kalium iodida adalah itu Yodium adalah elemen kimia sedangkan kalium iodida adalah senyawa kimia.
Yodium adalah halogen yang berada di kelompok 17 dari tabel elemen periodik. Di sisi lain, kalium iodida adalah senyawa kimia yang terbentuk dari kombinasi yodium dan kalium. Akibatnya, kalium iodida sangat berguna di banyak industri sebagai sumber yodium.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa yodium itu
3. Apa itu kalium iodida
4. Perbandingan berdampingan - yodium vs kalium iodida dalam bentuk tabel
5. Ringkasan
Apa yodium itu?
Yodium adalah elemen kimia yang memiliki nomor atom 53 dan simbol kimia i. Itu adalah halogen terberat di antara halogen lainnya. Halogen adalah elemen kimia kelompok 17 dalam tabel periodik. Selain itu, yodium ada sebagai padatan berwarna abu-abu berkilau pada suhu kamar. Namun, itu dapat dengan mudah mengalami sublimasi untuk membentuk gas ungu yodium. Selain itu, di antara keadaan oksidasi bahwa yodium dapat ada, oksidasi -1 adalah yang paling umum di antara mereka, yang menghasilkan anion iodida. Itu karena, yodium memiliki oktet yang tidak lengkap dalam konfigurasi elektronnya di mana ia membutuhkan elektron untuk menyelesaikan oktet. Kemudian, saat memperoleh elektron dari luar, ia membentuk keadaan oksidasi -1.
Beberapa fakta penting tentang yodium adalah sebagai berikut:
- Nomor Atom - 53
- Berat atom standar - 126.9
- Penampilan - kilau, grey -grey solid
- Konfigurasi Elektron - [Kr] 4D10 5S2 5p5
- Grup - 17
- Periode - 5
- Kategori Kimia - Non -logam
- Titik pencairan adalah 113.7 ° C
- Titik didih adalah 184.3 ° C

Gambar 01: Sampel yodium padat
Selain itu, yodium adalah pengoksidasi yang kuat. Terutama, ini karena oktet konfigurasi elektron yang tidak lengkap di mana ia tidak memiliki satu elektron untuk mengisi orbital P terluar paling. Dengan demikian, ia mencari elektron dengan mengoksidasi spesies kimia lainnya. Namun, itu adalah agen pengoksidasi terlemah di antara halogen lainnya karena ukuran atomnya yang besar.
Apa itu kalium iodida?
Kalium iodida adalah senyawa anorganik dan muncul sebagai padatan putih dan diproduksi secara komersial dalam jumlah besar. Ini adalah senyawa iodida yang paling penting karena kurang higroskopis daripada senyawa iodida lainnya. Formula kimia senyawa ini adalah ki.
Beberapa fakta kimia penting tentang senyawa ini adalah sebagai berikut:
- Formula Kimia - KI
- Massa molar - 166 g/mol.
- Titik lebur adalah 681 ° C.
- Titik didih adalah 1.330 ° C.
- Ini memiliki struktur kristal natrium klorida.
- Agen pereduksi ringan.
- Produksi secara industri dengan merawat KOH dengan yodium.

Gambar 02: Sampel kalium iodida padat
Aplikasi ki yang paling penting adalah dalam bentuk tablet SSKI (larutan jenuh kalium iodida juga). Tablet ini diambil dalam perawatan darurat beberapa penyakit. Juga, SSKI berguna untuk pengobatan dalam kasus paparan kecelakaan nuklir. Selain itu, Ki adalah suplemen untuk kekurangan yodium saat ditambahkan ke garam meja. Selain itu, kita dapat menggunakannya di industri fotografi dan di bidang penelitian biomedis.
Apa perbedaan antara yodium dan kalium iodida?
Yodium adalah elemen kimia yang memiliki nomor atom 53 dan simbol kimia I sedangkan kalium iodida adalah senyawa anorganik dan muncul sebagai padatan putih dan diproduksi secara komersial dalam jumlah besar. Oleh karena itu, perbedaan utama antara yodium dan kalium iodida adalah bahwa yodium adalah elemen kimia sedangkan kalium iodida adalah senyawa kimia. Singkatnya, yodium digabungkan dengan kalium (e.G., Koh) untuk menghasilkan senyawa kalium iodida. Sebagai perbedaan penting lainnya antara yodium dan kalium iodida, kita dapat mengatakan bahwa yodium memiliki penampilan kilau dan abu-abu logam sedangkan kalium iodida muncul sebagai senyawa padat putih.
Selain itu, ada perbedaan antara yodium dan kalium iodida dalam penggunaannya juga. Juga, ada beberapa perbedaan lain dalam sifat kimianya juga. Infografis di bawah ini merangkum perbedaan antara yodium dan kalium iodida dalam bentuk tabel.
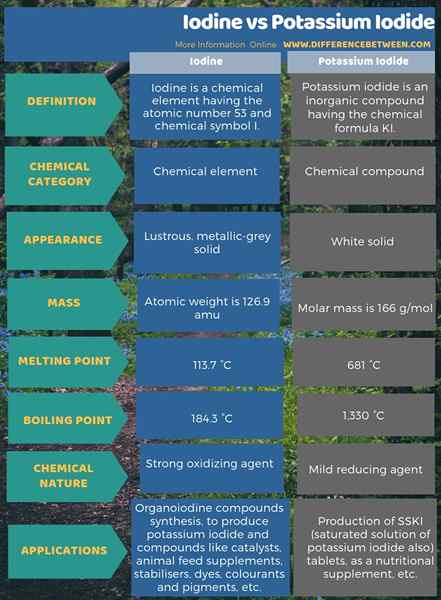
Ringkasan -yodium vs kalium iodida
Yodium menjadi halogen tidak dapat tetap sebagai elemen di bawah suhu dan tekanan standar tetapi bergabung dengan elemen lain untuk membentuk senyawa dengan mudah. Oleh karena itu, sifat inilah untuk membentuk senyawa yang menjadikannya elemen yang sangat penting. Oleh karena itu, perbedaan utama antara yodium dan kalium iodida adalah bahwa yodium adalah elemen kimia sedangkan kalium iodida adalah senyawa kimia. Yodium bergabung dengan kalium untuk membentuk kalium iodida yang merupakan senyawa yang sangat penting yang berguna secara komersial di berbagai industri. Namun, isotop yodium berbahaya bagi manusia, tetapi ketika yodium ini diambil dalam bentuk ki, itu menjadi berguna bagi manusia. Selain itu, kekurangan yodium menyebabkan keterbelakangan mental dan gondok, kekurangan ini dipenuhi oleh pemberian yodium dalam bentuk ki.
Referensi:
1."Yodium.”Wikipedia, Wikimedia Foundation, 20 Okt. 2018. Tersedia disini
2.“Kalium iodida.”Wikipedia, Wikimedia Foundation, 26 September. 2018. Tersedia disini
Gambar milik:
1."Sampel yodium" oleh lhchem - karya sendiri, (cc by -sa 3.0) Via Commons Wikimedia
2."Potassium iodide" (domain publik) via Commons Wikimedia


