Perbedaan antara ionisasi dan elektrolisis
Itu perbedaan utama Antara ionisasi dan elektrolisis adalah itu Ionisasi adalah pembentukan spesies kimia yang memiliki muatan listrik, sedangkan elektrolisis adalah proses menggunakan arus listrik untuk melakukan reaksi kimia yang tidak kontan.
Ionisasi dan elektrolisis adalah proses yang sangat penting dalam kimia fisik. Ada berbagai cara untuk melakukan proses ionisasi. Elektrolisis juga dapat digunakan untuk mengionisasi spesies kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ionisasi
3. Apa itu elektrolisis
4. Perbandingan berdampingan -ionisasi vs elektrolisis dalam bentuk tabel
5. Ringkasan
Apa itu ionisasi?
Ionisasi adalah proses kimia di mana atom atau molekul mendapatkan muatan positif atau negatif. Itu terjadi karena masing -masing menghilangkan atau mendapatkan elektron dari atom atau molekul. Di sini, ion yang dihasilkan dinamai kation atau anion, tergantung pada muatan yang mereka miliki, saya.e. kation adalah ion dan anion yang bermuatan positif adalah ion yang bermuatan negatif. Pada dasarnya, hilangnya elektron dari atom netral atau molekul membentuk kation dan gain elektron dari atom netral memberikan muatan negatif, membentuk anion.
Saat elektron dikeluarkan dari atom gas netral dengan penambahan energi, ia membentuk kation monovalen. Itu karena atom netral memiliki jumlah elektron dan proton yang sama, menghasilkan tidak ada muatan bersih; Saat kita menghapus elektron dari atom itu, ada satu proton berlebih yang tidak memiliki elektron untuk menetralisir muatannya. Oleh karena itu, atom itu mendapat muatan +1 (itu adalah muatan proton). Jumlah energi yang dibutuhkan untuk ini adalah energi ionisasi pertama dari atom itu.
Selain itu, ionisasi yang terjadi dalam larutan cair adalah pembentukan ion dalam larutan. Misalnya, ketika molekul HCl larut dalam air, ion hidronium (h3HAI+) terbentuk. Di sini, HCL bereaksi dengan molekul air dan membentuk ion hidronium bermuatan positif dan klorida bermuatan negatif (CL-) ion.
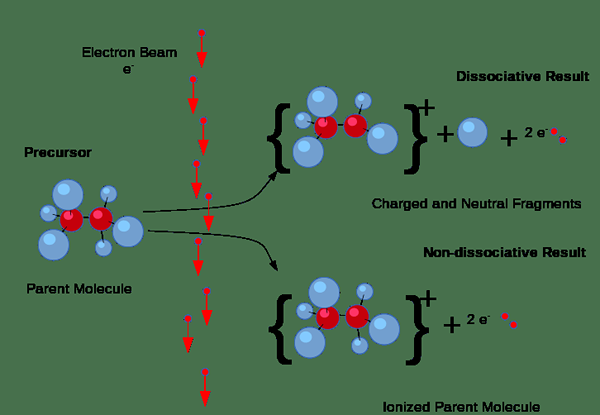
Selanjutnya, ionisasi dapat terjadi melalui tabrakan. Tapi, jenis ionisasi ini terjadi terutama pada gas ketika arus listrik melewati gas. Jika elektron dalam arus memiliki jumlah energi yang cukup yang diperlukan untuk menghilangkan elektron dari molekul gas, mereka akan memaksa keluar elektron dari molekul gas, menghasilkan pasangan ion yang terdiri dari ion positif individu dan elektron negatif negatif. Di sini, ion negatif juga terbentuk karena beberapa elektron cenderung menempel pada molekul gas daripada menarik elektron keluar.
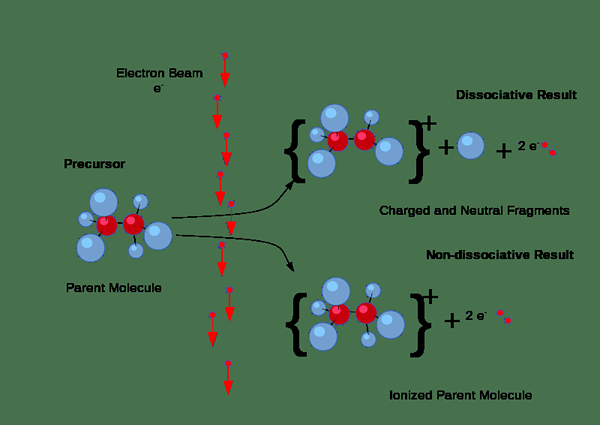
Gambar 01: Proses ionisasi
Selain itu, ionisasi terjadi ketika energi radiasi atau partikel bermuatan yang cukup energik melewati padatan, cairan atau gas; Misalnya, partikel alfa, partikel beta, dan radiasi gamma dapat mengionisasi zat; Oleh karena itu, kami menyebutkan mereka sebagai radiasi pengion.
Apa itu elektrolisis?
Elektrolisis adalah proses menggunakan arus listrik langsung untuk menggerakkan reaksi kimia yang tidak kontan. Kita bisa melakukan ini dengan menggunakan sel elektrolitik. Teknik elektrolisis penting untuk memisahkan senyawa menjadi ion atau komponen lainnya.
Dalam elektrolisis, arus listrik melewati solusi untuk mobilitas ion dalam larutan itu. Sel elektrolitik mengandung dua elektroda yang direndam dalam larutan yang sama. Dan, solusi ini adalah elektrolit. Faktor penting dalam mengatur sel elektrolitik adalah "terlalu potensial". Kami harus memberikan tegangan yang lebih tinggi untuk melakukan reaksi non-spontan. Di sini, elektroda inert juga dapat digunakan untuk menyediakan permukaan untuk reaksi yang terjadi.
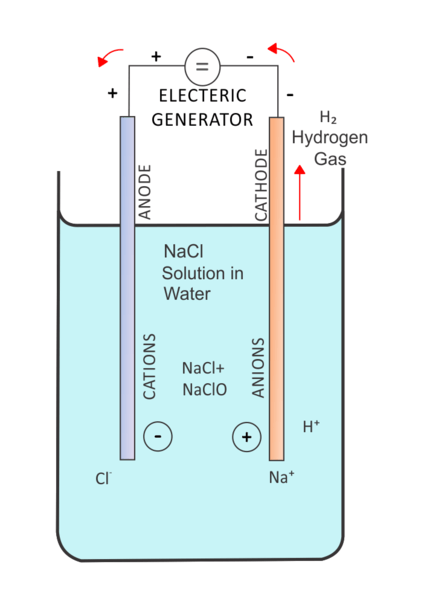
Gambar 02: Elektrolisis larutan garam
Ada banyak aplikasi elektrolisis. Salah satu aplikasi umum adalah elektrolisis air. Di sini, air adalah elektrolit. Kemudian reaksi pemecahan molekul air menjadi gas hidrogen dan oksigen dilakukan dengan menggunakan arus listrik yang dilewatkan melalui elektrolit.
Apa perbedaan antara ionisasi dan elektrolisis?
Ionisasi dan elektrolisis adalah proses yang sangat penting dalam kimia fisik. Perbedaan utama antara ionisasi dan elektrolisis adalah ionisasi adalah pembentukan spesies kimia yang memiliki muatan listrik, sedangkan elektrolisis adalah proses menggunakan arus listrik untuk melakukan reaksi kimia non-spontan.
Saat mempertimbangkan prosesnya, ionisasi dapat terjadi karena beberapa alasan seperti reaksi antara spesies netral dan zat pengion, karena tabrakan, karena radiasi pengion, dll. Namun, semua metode ini mengarah pada penghapusan atau penambahan elektron ke komponen kimia, i.e. Penghapusan elektron membentuk kation dan mendapatkan satu elektron membentuk anion. Elektrolisis juga merupakan metode yang dapat kita gunakan untuk ionisasi senyawa. Jadi, ini adalah perbedaan lain antara ionisasi dan elektrolisis.

Ringkasan -ionisasi vs elektrolisis
Ionisasi dan elektrolisis adalah proses yang sangat penting dalam kimia fisik. Perbedaan utama antara ionisasi dan elektrolisis adalah ionisasi adalah pembentukan spesies kimia yang memiliki muatan listrik, sedangkan elektrolisis adalah proses menggunakan arus listrik untuk melakukan reaksi kimia non-spontan.
Referensi:
1. Helmenstine, Anne Marie. “Definisi elektrolisis dalam kimia."Thoughtco, Feb. 7, 2019, tersedia di sini.
Gambar milik:
1. "Ionisasi elektron" oleh Evan Mason - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. "Elektrolisis garam" oleh Sarah.Blumen - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


