Perbedaan antara metana dan etana

Perbedaan Utama - Metana vs Ethane
Metana dan etana adalah anggota terkecil dari keluarga Alkane. Rumus molekuler dari dua senyawa organik ini adalah CH4 dan C2H6 masing -masing. Itu perbedaan utama antara metana dan etana adalah struktur kimianya; Molekul etana dapat dianggap sebagai dua gugus metil yang bergabung sebagai dimer gugus metil. Perbedaan kimia dan fisik lainnya terutama muncul karena perbedaan struktural ini.
Apa itu metana?
Metana adalah anggota terkecil dari keluarga Alkane dengan formula kimia ch4 (Empat atom hidrogen terikat pada satu atom karbon). Itu dianggap sebagai komponen utama gas alam. Metana adalah gas yang tidak berwarna, tidak berbau dan hambar; juga dikenal sebagai carbane, gas rawa, gas alam, karbon tetrahidrida, Dan Hidrogen karbida. Itu bisa dengan mudah dinyalakan, dan uapnya lebih ringan dari udara.
Metana secara alami ditemukan di bawah tanah dan di bawah dasar laut. Metana atmosfer dianggap sebagai gas rumah kaca. Metana pecah menjadi ch3- dengan air di atmosfer. 
Apa itu Ethane?
Ethane adalah senyawa gas yang tidak berwarna dan tidak berbau pada suhu dan tekanan standar. Formula molekulnya dan berat molekulnya adalah C2H6 dan 30.07 g · mol−1 masing -masing. Itu diisolasi dari gas alam, sebagai produk sampingan dari proses pemurnian minyak bumi. Ethane sangat penting dalam produksi etilena. 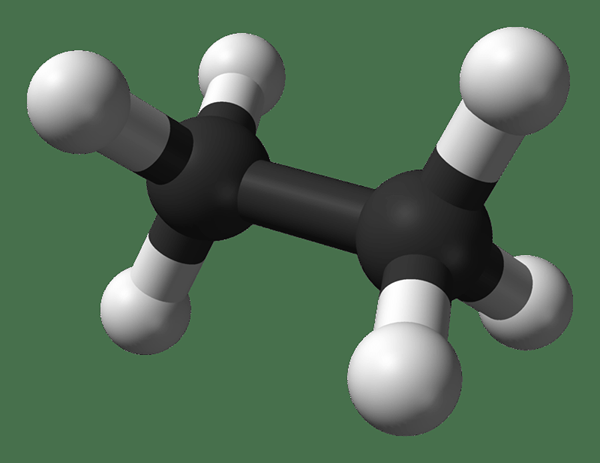
Apa perbedaan antara metana dan etana?
Karakteristik metana dan etana
Struktur:
Metana: Itu Formula molekul dari metana adalah Ch4, Dan itu adalah contoh molekul tetrahedral dengan empat ikatan C-H yang setara (ikatan sigma). Sudut ikatan antara atom H-C-H adalah 109.50 Dan semua ikatan C-H setara, dan sama dengan 108.70 PM.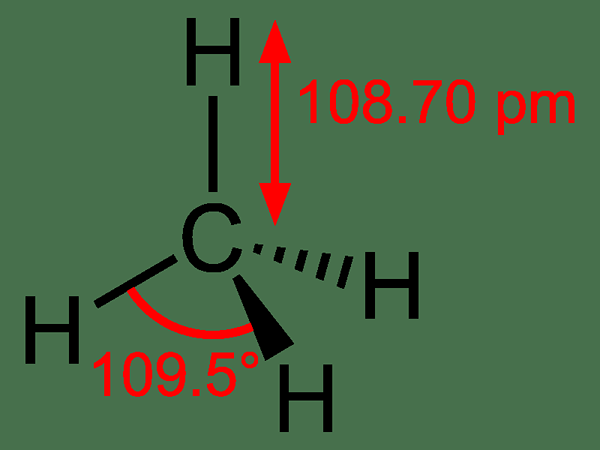
Ethane: Itu Formula Etana Molekuler adalah C2H6, dan itu adalah hidrokarbon jenuh karena tidak mengandung banyak ikatan.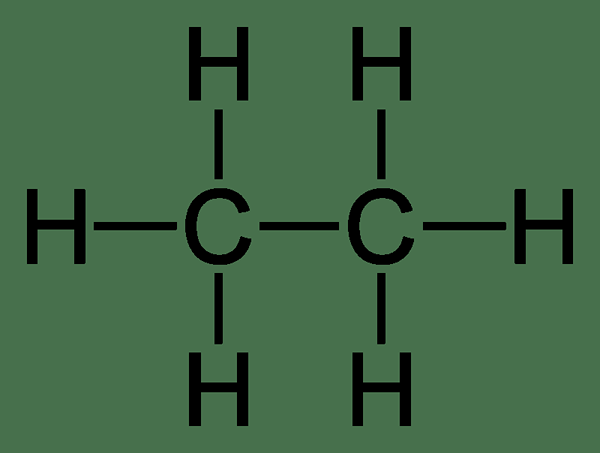
Sifat Kimia:
Metana:
Stabilitas: Metana adalah molekul kimia yang sangat stabil yang tidak bereaksi dengan kmno4, K2Cr2HAI7, H2JADI4 atau hno3 dalam kondisi normal.
Pembakaran: Di hadapan udara berlebih atau oksigen, metana terbakar dengan api biru pucat yang menghasilkan karbon dioksida dan air. Ini adalah reaksi yang sangat eksotermik; Oleh karena itu, ini digunakan sebagai bahan bakar yang sangat baik. Di hadapan udara atau oksigen yang tidak mencukupi, sebagian terbakar menjadi gas karbon monoksida (CO).
Reaksi Substitusi: Metana menunjukkan reaksi substitusi dengan halogen. Dalam reaksi ini, satu atau lebih atom hidrogen digantikan oleh jumlah atom halogen yang sama dan disebut “halogenasi.“Ini bereaksi dengan klorin (CL) dan bromin (BR) di hadapan sinar matahari.
Reaksi dengan Steam: Ketika campuran metana dan uap dilewatkan melalui nikel yang dipanaskan (1000 K) yang didukung pada permukaan alumina, ia dapat menghasilkan hidrogen.
Pirolisis: Saat metana dipanaskan hingga sekitar 1300 K, ia terurai menjadi karbon hitam dan hidrogen.
Ethane:
Reaksi: Gas Ethane (CH3Ch3) bereaksi dengan uap brom di hadapan cahaya untuk membentuk bromoetana, (ch3Ch2Br) dan hidrogen bromida (HBR). Itu adalah reaksi substitusi; Atom hidrogen dalam etana diganti dengan atom brom.
Ch3Ch3 + Br2 à ch3Ch2BR +HBR
Pembakaran: Pembakaran lengkap etana menghasilkan 1559.7 kJ/mol (51.9 kJ/g) panas, karbon dioksida, dan air.
2 c2H6 + 7 HAI2 → 4 BERSAMA2 + 6 H2HAI + 3120 kJ
Itu juga dapat terjadi tanpa kelebihan oksigen, menghasilkan campuran karbon amorf dan karbon monoksida.
2 c2H6 + 3 HAI2 → 4 C + 6 H2HAI + energi
2 c2H6 + 5 HAI2 → 4 Co + 6 H2HAI + energi
2 c2H6 + 4 HAI2 → 2 C + 2 CO + 6 H2HAI + energi dll.
Definisi:
Reaksi substitusi: Reaksi substitusi adalah reaksi kimia yang melibatkan perpindahan satu kelompok fungsional dalam senyawa kimia dan menggantinya oleh kelompok fungsional lain.
Penggunaan:
Metana: Metana digunakan dalam banyak proses kimia industri (sebagai bahan bakar, gas alam, gas alam cair) dan diangkut sebagai cairan yang didinginkan.
Ethane: Ethane digunakan sebagai bahan bakar untuk motor dan sebagai refrigeran untuk sistem suhu yang sangat rendah. Ini dikirim dalam silinder baja sebagai gas cair di bawah tekanan uapnya sendiri.
Referensi: "Ethane". Wikipedia. N.P., 2016. Web. 7 Juni 2016. Khanna, Bhishm. “Apa sifat kimia metana ?". Preserveartles.com. N.P., 2016. Web. 7 Juni 2016. “Metana | CH4 - PUBCHEM ”. Pubchem.NCBI.nlm.nih.pemerintah. N.P., 2016. Web. 7 Juni 2016. "Metana". Wikipedia. N.P., 2016. Web. 7 Juni 2016. Gambar milik: “Model Ball-and-Stick Molekul Metana” oleh (Domain Publik) melalui Commons Wikimedia “Model Ball-and-Stick Molekul Etana” Y Ben Mills-Pekerjaan Sendiri (Domain Publik) melalui Commons Wikimedia “Metana” oleh Jynto-Pekerjaan Sendiri, Berdasarkan File: Methane-CRC-MW-dimensi-2D.PNG, (domain publik) via commons wikimedia "ethane" (domain publik) via commons wikimedia

