Perbedaan antara orbital molekul dan orbital atom

Itu perbedaan utama Antara orbital molekul dan orbital atom adalah itu Orbital atom menggambarkan lokasi di mana probabilitas menemukan elektron tinggi dalam atom sedangkan orbital molekuler menggambarkan kemungkinan lokasi elektron dalam molekul.
Ikatan dalam molekul dipahami dengan cara baru dengan teori -teori baru yang disajikan oleh Schrodinger, Heisenberg dan Paul Dirac. Ketika mekanika kuantum masuk ke dalam gambar dengan temuan mereka, ditemukan bahwa elektron memiliki sifat partikel dan gelombang. Dengan ini, Schrodinger mengembangkan persamaan untuk menemukan sifat gelombang elektron dan muncul dengan persamaan gelombang dan fungsi gelombang. Fungsi gelombang (ψ) sesuai dengan keadaan yang berbeda untuk elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu orbital molekuler
3. Apa itu orbital atom
4. Perbandingan berdampingan - Orbital orbital molekul vs orbital atom dalam bentuk tabel
5. Ringkasan
Apa itu orbital molekuler?
Atom bergabung bersama untuk membentuk molekul. Ketika dua atom bergerak lebih dekat bersama untuk membentuk molekul, orbital atom tumpang tindih dan bergabung menjadi orbital molekuler. Jumlah orbital molekul yang baru terbentuk sama dengan jumlah orbital atom gabungan. Selain itu, orbital molekul mengelilingi dua inti atom, dan elektron dapat bergerak di sekitar kedua nuklei. Mirip dengan orbital atom, orbital molekul secara maksimal mengandung 2 elektron, yang memiliki putaran yang berlawanan.
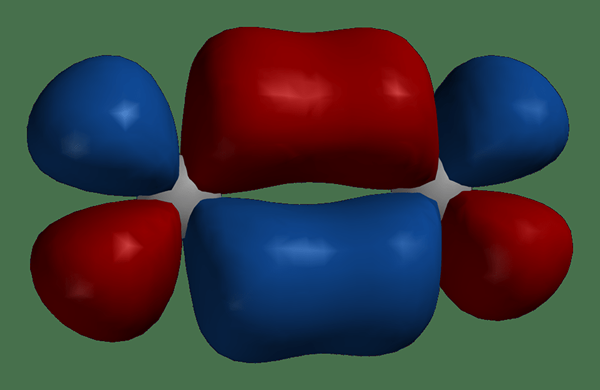
Gambar 01: Orbital molekul dalam molekul
Selain itu, ada dua jenis orbital molekuler: orbital molekul ikatan dan orbital molekul antibondasi. Orbital molekul ikatan mengandung elektron dalam keadaan tanah sementara orbital molekul antibonding tidak mengandung elektron dalam keadaan tanah. Selain itu, elektron dapat menempati orbital antibonding jika molekulnya dalam keadaan tereksitasi.
Apa itu orbital atom?
Max Born menunjukkan makna fisik ke kuadrat fungsi gelombang (ψ2) setelah Schrodinger mengedepankan teorinya. Menurut Born, ψ2 menyatakan probabilitas menemukan elektron di lokasi tertentu; Jika ψ2 adalah nilai yang besar, maka probabilitas menemukan elektron di ruang itu lebih tinggi. Oleh karena itu, di ruang angkasa, kepadatan probabilitas elektron besar. Namun, jika ψ2 rendah, maka kepadatan probabilitas elektron rendah. Plot ψ2 dalam sumbu x, y dan z menunjukkan probabilitas ini, dan mereka mengambil bentuk orbital s, p, d dan f. Kami menyebut orbital atom ini.

Gambar 02: orbital atom yang berbeda
Selain itu, kami mendefinisikan orbital atom sebagai daerah ruang di mana probabilitas menemukan elektron besar dalam atom. Kita dapat mengkarakterisasi orbital ini dengan angka kuantum, dan setiap orbital atom dapat menampung dua elektron dengan putaran yang berlawanan. Misalnya, saat kami menulis konfigurasi elektron, kami menulisnya sebagai 1S2, 2S2, 2P6, 3S2. 1, 2, 3… .N nilai integer adalah angka kuantum. Superskrip setelah nama orbital menunjukkan jumlah elektron dalam orbital itu. Orbital S berbentuk bola, dan kecil sementara orbital P berbentuk dumbel dengan dua lobus. Di sini, satu lobus positif sementara lobus lainnya negatif. Selain itu, tempat di mana dua lobus saling menyentuh adalah node. Ada 3 p orbital sebagai x, y dan z. Mereka diatur dalam ruang sedemikian rupa sehingga kapak mereka saling tegak lurus.
Ada lima orbital D dan 7 f orbital dengan bentuk yang berbeda. Oleh karena itu, berikut ini adalah jumlah total elektron yang dapat berada dalam orbital.
- s orbital-2 elektron
- P Orbitals- 6 Elektron
- d Orbital- 10 Elektron
- F orbital- 14 elektron
Apa perbedaan antara orbital molekul dan orbital atom?
Perbedaan utama antara orbital orbital molekul dan orbital atom adalah bahwa orbital atom menggambarkan lokasi di mana probabilitas menemukan elektron tinggi dalam atom sedangkan orbital molekul menggambarkan kemungkinan lokasi elektron dalam molekul. Selain itu, orbital atom hadir dalam atom sementara orbital molekul hadir dalam molekul. Selain itu, kombinasi orbital atom menghasilkan pembentukan orbital molekuler. Selain itu, orbital atom dinamai sebagai S, P, D, dan F sementara ada dua jenis orbital molekuler sebagai ikatan dan orbital molekul antibondasi.
Ringkasan -Orbital orbital molekul vs atom orbital
Perbedaan utama antara orbital orbital molekul dan orbital atom adalah bahwa orbital atom menggambarkan lokasi di mana probabilitas menemukan elektron tinggi dalam atom sedangkan orbital molekul menggambarkan kemungkinan lokasi elektron dalam molekul.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh orbital."Thoughtco, May. 7, 2019, tersedia di sini.
Gambar milik:
1. "Model pengisian ruang dari ikatan PI (orbital molekul ikatan dengan π simetri) yang dihasilkan oleh tumpang tindih ..." oleh Ben Mills (domain publik) melalui file domain publik
2. “Atomic-Orbital-Clouds SPD M0” oleh Geek3-karya sendiri; Dibuat dengan hidrogen-cloud dalam grafik Pythonthis PNG dibuat dengan Python (CC BY-SA 4.0) Via Commons Wikimedia


