Perbedaan antara teori orbital molekuler dan teori hibridisasi
Itu perbedaan utama Antara teori orbital molekuler dan teori hibridisasi adalah itu Teori orbital molekuler menggambarkan pembentukan ikatan dan orbital anti-ikatan, sedangkan teori hibridisasi menggambarkan pembentukan orbital hibrida.
Ada berbagai teori yang dikembangkan untuk menentukan struktur elektronik dan orbital molekul. Teori VSEPR, Teori Lewis, Teori Ikatan Valensi, Teori Hibridisasi dan Teori Orbital Molekuler adalah Teori Penting. Teori yang paling dapat diterima di antara mereka adalah teori orbital molekuler.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu teori orbital molekuler
3. Apa itu teori hibridisasi
4. Perbandingan Berdampingan - Teori Orbital Molekuler vs Teori Hibridisasi
5. Ringkasan
Apa itu teori orbital molekuler?
Teori Orbital Molekul adalah teknik menggambarkan struktur elektronik molekul menggunakan mekanika kuantum. Ini adalah cara paling produktif untuk menjelaskan ikatan kimia dalam molekul. Mari kita bahas teori ini secara rinci.
Pertama, kita perlu tahu apa itu orbital molekul. Ikatan kimia terbentuk antara dua atom ketika gaya menarik bersih antara dua inti atom dan elektron di antara mereka melebihi tolakan elektrostatik antara dua inti atom. Pada dasarnya, ini berarti, kekuatan yang menarik antara dua atom harus lebih tinggi dari kekuatan menjijikkan antara kedua atom tersebut. Di sini, elektron harus ada di wilayah yang disebut "wilayah pengikat", untuk membentuk ikatan kimia ini. Jika tidak, elektron akan berada di "daerah anti-ikatan" yang akan membantu gaya tolak antara atom.
Namun, jika persyaratan dipenuhi dan bentuk ikatan kimia antara dua atom, maka orbital yang sesuai yang terlibat dalam ikatan disebut orbital molekuler. Di sini, kita dapat mulai dengan dua orbital dari dua atom dan berakhir dengan satu orbital (orbital molekul) yang termasuk dalam kedua atom.
Menurut mekanika kuantum, orbital atom tidak dapat muncul atau menghilang seperti yang kita inginkan. Ketika orbital berinteraksi satu sama lain, mereka cenderung mengubah bentuknya sesuai. Tetapi menurut mekanika kuantum, mereka bebas mengubah bentuk tetapi perlu memiliki jumlah orbital yang sama. Maka kita perlu menemukan orbital yang hilang. Di sini, kombinasi in-fase dari dua orbital atom membuat orbital ikatan saat kombinasi di luar fase membentuk orbital anti-ikatan.
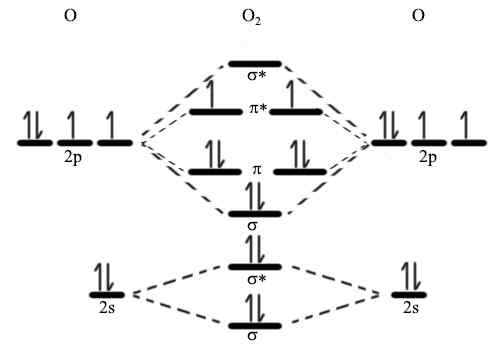
Gambar 01: Diagram Orbital Molekul
Elektron ikatan menempati orbital ikatan sementara elektron dalam orbital anti-ikatan tidak berpartisipasi dalam pembentukan ikatan. Sebaliknya, elektron -elektron ini secara aktif menentang pembentukan ikatan kimia. Orbital ikatan memiliki energi potensial yang lebih rendah daripada orbital anti-ikatan. Jika kita mempertimbangkan ikatan sigma, denotasi untuk orbital ikatan adalah σ, dan orbital anti-ikatan adalah σ*. Kita dapat menggunakan teori ini untuk menggambarkan struktur molekul rumit untuk menjelaskan mengapa beberapa molekul tidak ada (i.e. Dia2) dan urutan ikatan molekul. Dengan demikian, deskripsi ini secara singkat menjelaskan dasar teori orbital molekuler.
Apa itu teori hibridisasi?
Teori hibridisasi adalah teknik yang kami gunakan untuk menggambarkan struktur orbital molekul. Hibridisasi adalah pembentukan orbital hibrida dengan mencampur dua atau lebih orbital atom. Orientasi orbital ini menentukan geometri molekul. Ini adalah perluasan teori ikatan valensi.
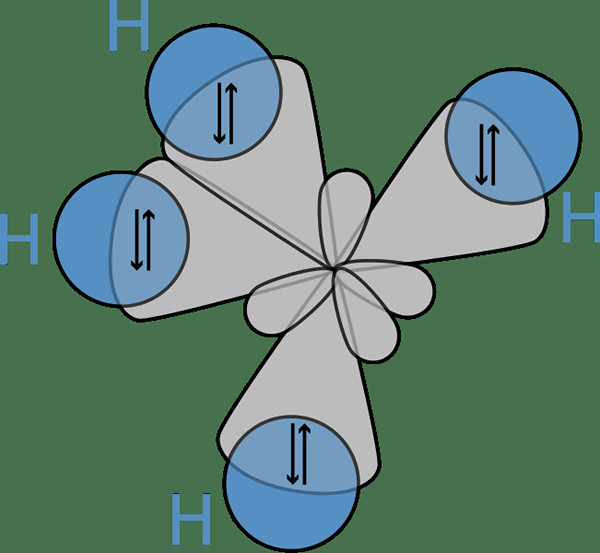
Sebelum pembentukan orbital atom, mereka memiliki energi yang berbeda, tetapi setelah pembentukan, semua orbital memiliki energi yang sama. Misalnya, orbital atom S, dan orbital atom P dapat bergabung untuk membentuk dua orbital SP. Orbital atom S dan P memiliki energi yang berbeda (energi S < energy of p). But after the hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Gambar 02: Ikatan antara orbital hibrida atom karbon dan S orbital atom hidrogen
Gagasan hibridisasi pertama kali masuk ke dalam diskusi karena para ilmuwan mengamati bahwa teori ikatan valensi gagal memprediksi struktur beberapa molekul seperti CH dengan benar4. Di sini, meskipun atom karbon hanya memiliki dua elektron yang tidak berpasangan sesuai dengan konfigurasi elektronnya, ia dapat membentuk empat ikatan kovalen. Untuk membentuk empat ikatan, harus ada empat elektron yang tidak berpasangan.
Satu -satunya cara mereka bisa menjelaskan fenomena ini adalah dengan berpikir bahwa orbital s dan p karbon sekering satu sama lain untuk membentuk orbital baru yang disebut orbital hibrida yang memiliki energi yang sama. Di sini, satu S + tiga P memberikan 4 sp3 orbital. Oleh karena itu, elektron mengisi orbital hibrida ini secara merata (satu elektron per orbital hibrida), mematuhi aturan hund. Lalu ada empat elektron untuk pembentukan empat ikatan kovalen dengan empat atom hidrogen.
Apa perbedaan antara teori orbital molekuler dan teori hibridisasi?
Teori orbital molekuler adalah teknik menggambarkan struktur elektronik molekul menggunakan mekanika kuantum. Teori hibridisasi adalah teknik yang kami gunakan untuk menggambarkan struktur orbital molekul. Jadi, perbedaan utama antara teori orbital molekuler dan teori hibridisasi adalah bahwa teori orbital molekuler menggambarkan pembentukan ikatan dan orbital anti-ikatan, sedangkan teori hibridisasi menggambarkan pembentukan orbital hibrida.
Lebih lanjut, menurut teori orbital molekuler, bentuk orbital baru dari pencampuran orbital atom dari dua atom saat dalam teori hibridisasi, bentuk orbital baru membentuk pencampuran orbital atom dari atom yang sama. Oleh karena itu, ini adalah perbedaan lain antara teori orbital molekuler dan teori hibridisasi.
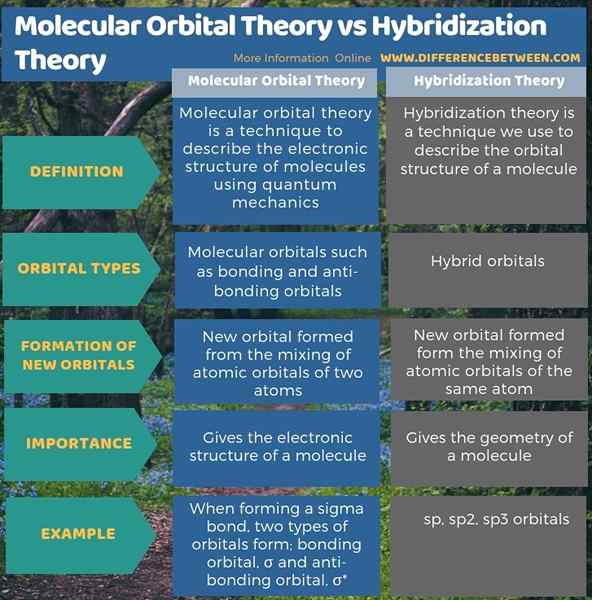
Ringkasan -Teori Orbital Molekuler vs Teori Hibridisasi
Baik teori orbital molekuler dan teori hibridisasi penting dalam menentukan struktur molekul. Perbedaan utama antara teori orbital molekuler dan teori hibridisasi adalah bahwa teori orbital molekuler menggambarkan pembentukan ikatan dan orbital anti-ikatan, sedangkan teori hibridisasi menggambarkan pembentukan orbital hibrida.
Referensi:
1. "Hibridisasi.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "O2Moleculardiagramcr" oleh Tcreuter - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Hibridisasi CH4” oleh K. Aainsqatsi at English Wikipedia (Teks Asli: K. Aainsqatsi) - Karya Sendiri (Teks Asli: Buatan Sendiri) (Domain Publik) Via Commons Wikimedia


