Perbedaan antara elektrolisis cair dan berair
Itu perbedaan utama Antara elektrolisis cair dan berair adalah itu Elektrolisis cair menghasilkan elemen analit, sedangkan elektrolisis berair menghasilkan larutan garam berair dan campuran gas sebagai produk akhir.
Elektrolisis cair dan berair adalah dua jenis metode elektrolisis dalam kimia analitik yang berbeda satu sama lain sesuai dengan sifat -sifat media elektrolitik. Istilah "cair" mengacu pada keadaan cair analit tanpa adanya air sementara istilah "berair" mengacu pada keadaan cair di hadapan air.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektrolisis cair
3. Apa itu elektrolisis berair
4. Perbandingan berdampingan - elektrolisis cair vs berair dalam bentuk tabel
5. Ringkasan
Apa itu elektrolisis cair?
Elektrolisis cair adalah teknik dalam kimia analitik yang menggunakan arus listrik untuk memisahkan elemen kimia dalam zat analit dalam keadaan cairnya. Secara umum, senyawa ionik digunakan dalam metode elektrolisis jenis ini. Teknik ini memberikan informasi tentang bagaimana kita dapat mengekstrak logam seperti aluminium dan natrium dari senyawa ionik cair menggunakan arus listrik.
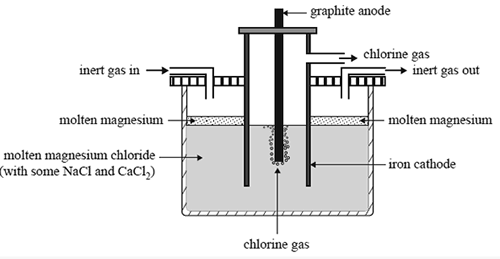
Gambar 01: Ekstraksi logam magnesium
Misalnya, aluminium adalah logam paling berlimpah di permukaan bumi, tetapi tidak terjadi dalam keadaan murni di alam. Sebaliknya, itu terjadi sebagai senyawa ionik dalam mineral. Oleh karena itu, kita harus memisahkan aluminium dari senyawanya melalui elektrolisis. Di sini, kami menggunakan senyawa ionik cair. Senyawa ionik terbentuk karena pembentukan ikatan ionik yang kuat yang ada antara kation dan anion. Dalam keadaan padat dari senyawa ionik, anion dan kation terkunci dalam struktur yang kaku sehingga mereka tidak dapat menghantarkan listrik. Oleh karena itu, kami tidak dapat menggunakan senyawa padat untuk elektrolisis. Tetapi dalam keadaan cairnya, senyawa ionik terpisah menjadi anion dan kation, memungkinkan keadaan cair analit untuk menghantarkan listrik. Kita bisa mendapatkan keadaan cair dengan melelehkan padatan. Oleh karena itu, kita dapat menyebutkan keadaan cair analit sebagai elektrolit.
Selama proses elektrolisis cair, kation bergerak menuju elektroda negatif sementara anion bergerak menuju elektroda positif. Pada elektroda negatif (katoda), kation mendapatkan elektron dan menjadi atom. Pada elektroda positif atau anoda, ion kehilangan elektron menjadi atom.
Apa itu elektrolisis berair?
Elektrolisis berair adalah teknik dalam kimia analitik yang menggunakan arus listrik untuk memisahkan elemen kimia dalam zat analit dalam keadaan berairnya. Jenis elektrolisis ini penting dalam mendapatkan zat atau gas tertentu. Misalnya, jika kita melewati arus listrik melalui air, itu membentuk gas hidrogen dan gas oksigen.

Gambar 02: Elektrolisis air
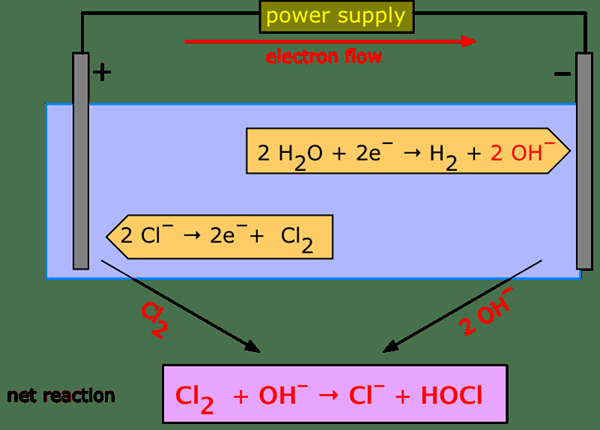
Dalam proses elektrolisis berair, arus listrik dilewatkan melalui elektrolit terionisasi; Di sini kation bergerak menuju anoda dan anion bergerak ke arah katoda. Jenis sistem ini disebut sel elektrolitik. Ada banyak aplikasi elektrolisis berair, termasuk elektroplating, menyempurnakan bauksit ke dalam aluminium, memproduksi klorin dan soda kaustik dari garam meja, dll.
Apa perbedaan antara elektrolisis cair dan berair?
Elektrolisis cair dan berair adalah teknik analitik dalam kimia yang berguna dalam memisahkan elemen kimia dalam zat analit. Perbedaan utama antara elektrolisis cair dan berair adalah bahwa elektrolisis cair menghasilkan elemen analit, sedangkan elektrolisis berair menghasilkan larutan garam berair dan campuran gas sebagai produk akhir.
Di bawah infografis menunjukkan lebih banyak perbandingan terkait dengan perbedaan antara elektrolisis cair dan berair.
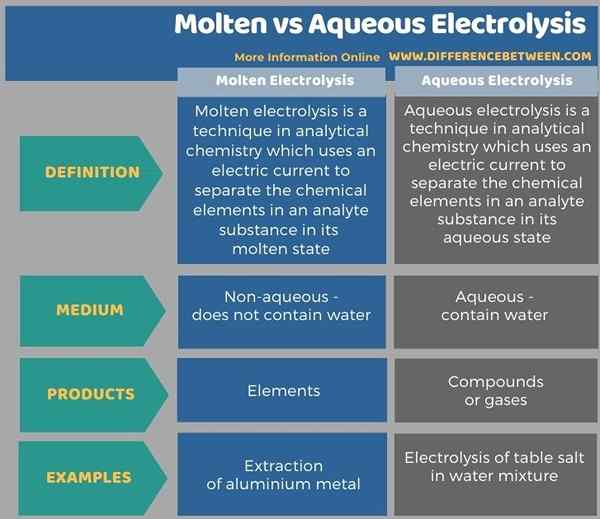
Ringkasan -elektrolisis cair vs air
Elektrolisis adalah teknik dalam kimia analitik yang mencakup penggunaan listrik untuk memisahkan elemen dalam suatu zat. Elektrolisis cair dan berair adalah dua jenis elektrolisis seperti itu. Perbedaan utama antara elektrolisis cair dan berair adalah bahwa elektrolisis cair menghasilkan elemen analit, sedangkan elektrolisis berair menghasilkan larutan garam berair dan campuran gas sebagai produk akhir.
Referensi:
1. “Elektrolisis senyawa cair." Belajar.com, tersedia di sini.
Gambar milik:
1. "Mg dengan elektrolisis" oleh Raveendra R.S. - Pekerjaan Sendiri (CC BY-SA 4.0) Via Commons Wikimedia
2. “Water Electrolysis NaCl” dengan pekerjaan yang lebih lambat - sendiri (CC BY -SA 3.0) Via Commons Wikimedia


