Perbedaan antara urutan reaksi dan molekuler
Perbedaan utama - Urutan reaksi vs molekul
Reaksi kimia adalah perubahan yang terjadi pada senyawa kimia. Itu mengarah pada konversi satu zat kimia ke yang lain. Senyawa awal yang mengalami reaksi kimia disebut reaktan. Apa yang kami dapatkan pada saat penyelesaian reaksi adalah produk. Urutan reaksi diberikan sehubungan dengan suatu zat; itu bisa sehubungan dengan reaktan, produk atau katalisator. Urutan reaksi sehubungan dengan suatu zat adalah eksponen di mana konsentrasinya dalam persamaan laju dinaikkan. Molekuleritas reaksi kimia mengungkapkan berapa banyak molekul reaktan yang terlibat dalam reaksi. Perbedaan utama antara urutan reaksi dan molekuler adalah bahwa Urutan reaksi memberikan hubungan antara konsentrasi spesies kimia dan reaksi yang dialaminya sedangkan molekulitas menunjukkan berapa banyak molekul reaktan yang terlibat dalam reaksi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa urutan reaksi
3. Apa itu molekuler
4. Perbandingan berdampingan - urutan reaksi vs molekulitas dalam bentuk tabel
5. Ringkasan
Apa urutan reaksi
Urutan reaksi sehubungan dengan suatu zat adalah eksponen di mana konsentrasinya dalam persamaan laju dinaikkan. Untuk memahami konsep ini, pertama -tama kita harus tahu apa tingkat hukum itu.
Menilai hukum
Hukum laju menunjukkan bahwa laju perkembangan reaksi kimia (pada suhu konstan) sebanding dengan konsentrasi reaktan yang diangkat ke eksponen yang ditentukan secara eksperimental. Eksponen ini dikenal sebagai perintah konsentrasi tersebut. Mari kita pertimbangkan contoh.
2n2HAI5 ↔ 4 no2 + HAI2
Untuk reaksi di atas, persamaan hukum laju diberikan seperti di bawah ini.
Tarif = k.[N2HAI5]X
Dalam persamaan di atas, k adalah konstanta proporsionalitas yang dikenal sebagai konstanta laju. Itu konstan pada suhu konstan. Kurung digunakan untuk menyatakan bahwa itu adalah konsentrasi reaktan. Simbol x adalah urutan reaksi sehubungan dengan reaktan. Nilai x harus ditentukan secara eksperimental. Untuk reaksi ini, telah ditemukan bahwa x = 1. Di sini, kita dapat melihat bahwa urutan reaksi tidak sama dengan stoikiometri reaksi. Tetapi dalam beberapa reaksi, urutan reaksi bisa sama dengan stoikiometri.
Untuk reaksi yang memiliki dua atau lebih reaktan, Tingkat Persamaan Hukum bisa ditulis seperti di bawah ini.
A+ b+ c ↔ p
Tarif = k.[A]A[B]B[C]C
A, B dan C adalah perintah reaksi sehubungan dengan reaktan A, B dan C, masing -masing. Untuk persamaan laju semacam ini (memiliki beberapa urutan reaksi), jumlah perintah reaksi diberikan sebagai urutan keseluruhan reaksi.
Pesanan keseluruhan = A + B + C

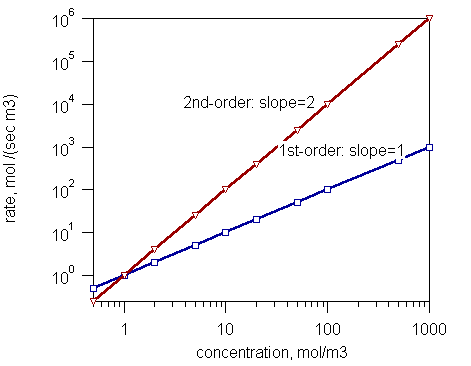
Gambar 1: Tingkat reaksi urutan pertama dan urutan kedua
Menurut urutan reaksi, ada beberapa jenis reaksi:
- Nol reaksi pesanan (Urutan reaksi adalah nol sehubungan dengan reaktan yang digunakan. Oleh karena itu laju reaksi tidak tergantung pada konsentrasi reaktan yang digunakan.)
- Reaksi urutan pertama (laju sebanding dengan konsentrasi satu reaktan)
- Reaksi urutan kedua (Laju reaksi sebanding dengan kuadrat konsentrasi reaktan atau produk konsentrasi dua reaktan)
Apa itu molekuler
Molekulitas reaksi adalah jumlah molekul atau ion yang berpartisipasi dalam reaksi sebagai reaktan. Lebih penting lagi, reaktan yang dipertimbangkan adalah yang berpartisipasi dalam langkah penentu laju dari keseluruhan reaksi. Langkah penentu laju reaksi adalah langkah paling lambat dari reaksi keseluruhan. Ini karena langkah reaksi paling lambat menentukan laju reaksi.
Gambar 2: Reaksi unimolekul
Molekuleritas dapat dari berbagai jenis:
- Reaksi unimolekul memiliki satu molekul reaktan (atau ion)
- Reaksi bimolekul memiliki dua reaktan (dua reaktan dapat memiliki senyawa yang sama atau senyawa yang berbeda)
- Reaksi trimolekul memiliki tiga reaktan.
Apa perbedaan antara urutan reaksi dan molekuleritas?
Urutan reaksi vs molekul | |
| Urutan reaksi sehubungan dengan suatu zat adalah eksponen di mana konsentrasinya dalam persamaan laju dinaikkan. | Molekulitas reaksi adalah jumlah molekul atau ion yang berpartisipasi dalam reaksi sebagai reaktan. |
| Hubungan dengan reaktan | |
| Urutan reaksi menjelaskan bagaimana konsentrasi reaktan mempengaruhi laju reaksi. | Molekulitas memberikan jumlah reaktan yang mengambil bagian dalam suatu reaksi. |
Ringkasan - Urutan Reaksi vs Molekularitas
Hukum laju menunjukkan bahwa laju perkembangan reaksi kimia (pada suhu konstan) sebanding dengan konsentrasi reaktan yang diangkat ke eksponen yang ditentukan secara eksperimental. Urutan reaksi diberikan sehubungan dengan reaktan. Itu menjelaskan ketergantungan laju reaksi pada konsentrasi reaktan. Perbedaan utama antara urutan reaksi dan molekuler adalah bahwa urutan reaksi memberikan hubungan antara konsentrasi spesies kimia dan reaksi yang dialaminya sedangkan molekuler mengekspresikan berapa banyak molekul reaktan yang terlibat dalam reaksi tersebut.
Referensi:
1. “Hukum tingkat.”Kimia Libretexts, Libretexts, 21 Juli 2016, tersedia di sini.
2. “Urutan reaksi.”Kimia Libretexts, Libretexts, 21 Juli 2016, tersedia di sini.
3. “Molekuler dan kinetika.”Kimia Libretexts, Libretexts, 21 Juli 2016, tersedia di sini.
Gambar milik:
1. "Rateloglogplot" oleh Fabiuccio ~ enwikibooks di Wikibooks Inggris - ditransfer dari EN.wikibooks ke commons., (Domain publik) via commons wikimedia
2. “Cis-Trans-Stilbene” oleh Pancrat-karya sendiri (CC BY-SA 3.0) Via Commons Wikimedia


