Perbedaan antara nomor oksidasi dan muatan
Itu perbedaan utama Antara nomor oksidasi dan muatannya kita dapat menentukan jumlah oksidasi atom yang mempertimbangkan jumlah elektron yang dihapus atau diperoleh dengan atom itu sedangkan muatan ditentukan dengan mempertimbangkan jumlah total elektron dan proton dalam atom.
Elemen yang berbeda dalam tabel periodik menunjukkan karakteristik kimia dan fisik yang berbeda. Dan ketika mereka bergabung untuk membentuk molekul, elemen yang berbeda bergabung dengan elemen lain dalam proporsi yang berbeda. Di antara sejumlah besar variasi antara elemen, parameter yang paling sederhana dan penting adalah muatan dan nomor oksidasi mereka. Muatan dan jumlah oksidasi suatu elemen membantu mengidentifikasi, ke kelompok mana elemen ini termasuk dalam tabel periodik. Yang paling penting, ini membantu menggambarkan kemampuan elemen untuk membentuk molekul lain dan senyawa koordinasi, dan dengan demikian, membantu mengidentifikasi formula empiris mereka.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu nomor oksidasi
3. Apa itu biaya
4. Perbandingan berdampingan - Nomor oksidasi vs muatan dalam bentuk tabel
5. Ringkasan
Apa itu nomor oksidasi?
Jumlah oksidasi adalah karakteristik atom sentral dari senyawa koordinasi. Ini adalah muatan atom sentral dari senyawa koordinasi ketika semua ikatan di sekitar atom ini adalah ikatan ionik. Oleh karena itu, terkadang muatan dan bilangan oksidasi serupa, tetapi terkadang berbeda. Misalnya, elemen blok S sederhana dan P memiliki nomor oksidasi yang sama dengan muatannya. Juga, ion polyatomik memiliki nomor oksidasi yang sama dengan muatannya. Namun, elemen kimia yang sama dapat memiliki bilangan oksidasi yang berbeda, tergantung pada atom lain di sekitarnya. Dalam elemen bebas, nomor oksidasi selalu nol. Selanjutnya, ion logam transisi (blok D) dan elemen memiliki angka oksidasi yang berbeda.
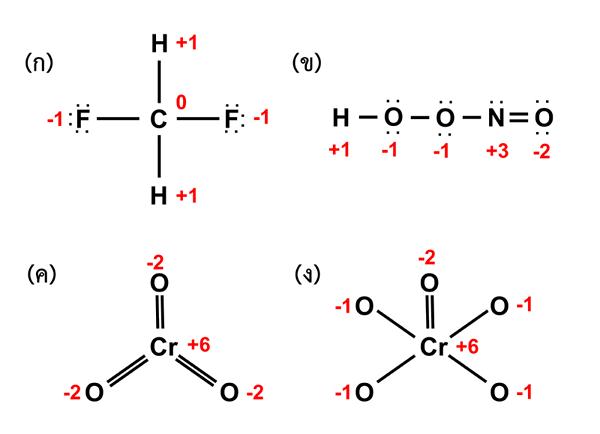
Gambar 01: Penentuan jumlah oksidasi elemen yang berbeda dalam senyawa
Saat mempertimbangkan senyawa koordinasi, atom logam pusat harus selalu memiliki orbital kosong yang ligannya menyumbangkan pasangan elektron tunggal dan membentuk ikatan ionik. Selain itu, kita dapat menunjukkan jumlah oksidasi atom logam tengah dengan nomor Romawi di dalam kurung. Misalnya, jika jumlah oksidasi logam "m" adalah 3, maka kami menulisnya sebagai m (iii).
Apa itu biaya?
Biaya atom apa pun adalah nol. Saat atom menghilangkan atau mendapatkan elektron, mereka mendapatkan muatan listrik. Itu karena, elektron adalah partikel subatomik bermuatan negatif sementara proton bermuatan positif. Atom melakukan penghapusan atau mendapatkan elektron untuk mengisi cangkang valensi mereka sesuai dengan aturan oktet.
Dalam atom, jumlah proton dan elektron sama. Karena proton memiliki muatan positif dan elektron memiliki muatan negatif, ketika elektron dari cangkang valensi menghapus, atom membentuk ion bermuatan positif, karena jumlah proton positif lebih tinggi dari jumlah elektron dalam ion tersebut.
Penentuan tuduhan
Selain itu, ketika sebuah atom lebih elektronegatif, ia dapat menarik elektron dari atom lain ke arah dirinya sendiri. Di sana, mereka mendapatkan lebih banyak elektron daripada jumlah proton berada di dalam nukleus mereka. Dengan demikian, atom menjadi ion negatif. Selanjutnya, jumlah elektron yang disumbangkan atau abstrak berbeda dari atom ke atom. Kita dapat memprediksi ini dari posisi elemen dalam tabel periodik. Biasanya, atom kelompok yang sama akan membentuk ion bermuatan yang sama, karena mereka memiliki jumlah elektron valensi yang sama.

Gambar 02: Struktur atom dalam menentukan muatan
Nomor grup juga menunjukkan jumlah elektron valensi; Oleh karena itu, kita dapat menentukan muatan ion yang dibentuk oleh atom dalam kelompok itu. Misalnya, kelompok satu elemen membentuk ion monovalen dengan +1 muatan listrik. Grup dua elemen membentuk ion yang divikal divalen. Grup Tiga dan Grup Empat Atom membentuk +3 dan +4 Ion yang Dibebankan sesuai. Dari kelompok lima ke kelompok tujuh, atom membuat ion bermuatan negatif, karena lebih mudah untuk mengisi elektron valensi mereka hanya dengan mendapatkan 2 atau 3 elektron daripada memancarkan lima, enam atau tujuh elektron. Oleh karena itu, kelompok lima elemen membuat -3 ion bermuatan, sedangkan elemen kelompok 6 membuat ion -2 dan elemen kelompok 7 membuat ion -1 ion. Selain ion yang hanya bermuatan ini, ada juga ion kompleks dengan biaya seperti NH4+ dan co32-dll.
Apa perbedaan antara nomor oksidasi dan muatan?
Nomor dan muatan oksidasi adalah dua istilah terkait dalam kimia. Namun, ada beberapa perbedaan antara nomor oksidasi dan muatan. Perbedaan utama antara nomor oksidasi dan muatan adalah bahwa kita dapat menentukan jumlah oksidasi atom yang mempertimbangkan jumlah elektron yang dihapus atau diperoleh dengan atom itu sedangkan muatan ditentukan dengan mempertimbangkan jumlah total elektron dan proton dalam atom.
Selain itu, mungkin ada beberapa angka oksidasi untuk elemen kimia yang sama tergantung pada atom di sekitarnya sementara muatan atom hanya variabel tergantung pada jumlah elektron dan proton dalam atom. Oleh karena itu, ini adalah perbedaan penting lainnya antara nomor oksidasi dan muatan.

Ringkasan -Nomor Oksidasi vs Charge
Nomor muatan dan oksidasi adalah dua istilah terkait. Perbedaan utama antara nomor oksidasi dan muatan adalah bahwa kita dapat menentukan jumlah oksidasi atom yang mempertimbangkan jumlah elektron yang dihapus atau diperoleh dengan atom itu sedangkan muatan ditentukan dengan mempertimbangkan jumlah total elektron dan proton dalam atom dalam atom.
Referensi:
1. “Nomor oksidasi.”Logam transisi. Tersedia disini
2. Libretexts. “Atom."Kimia Libretexts, National Science Foundation, 26 Nov. 2018. Tersedia disini
Gambar milik:
1."Penugasan Negara Oksidasi" oleh Saranphong Yimklan - pekerjaan sendiri, (domain publik) melalui Commons Wikimedia
2."Muatan Nuklir Efektif" dengan pekerjaan sendiri - muatan nuklir yang efektif.gif, (domain publik) via commons wikimedia


