Perbedaan antara potensi oksidasi dan potensi reduksi
Perbedaan utama antara potensi oksidasi dan potensi reduksi adalah Potensi oksidasi menunjukkan kecenderungan elemen kimia yang dioksidasi. Sebaliknya, potensi reduksi menunjukkan kecenderungan elemen kimia dikurangi.
Potensi oksidasi dan potensi reduksi adalah dua jenis nilai potensial elektroda untuk spesies kimia yang diberikan dalam volt pada kondisi standar. Oleh karena itu, kami menyebutkan potensi oksidasi standar dan potensi reduksi standar. Nilai potensi ini menentukan kemampuan spesies kimia tertentu untuk menjalani oksidasi/reduksi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa potensi oksidasi
3. Apa itu potensi pengurangan
4. Perbandingan Berdampingan - Potensi Potensi Oksidasi Vs Potensi Pengurangan Dalam Bentuk Tabel
5. Ringkasan
Apa potensi oksidasi?
Potensi oksidasi adalah nilai yang menunjukkan kecenderungan spesies kimia dioksidasi. Dengan kata lain, itu adalah kemampuan elektroda untuk kehilangan elektron (untuk teroksidasi). Biasanya, nilai ini diberikan pada kondisi standar; Oleh karena itu, kita harus menyebutkannya sebagai potensi oksidasi standar. Denotasi untuk istilah ini adalah SOP. Diukur dalam volt. Dan, ini sangat mirip dengan potensi pengurangan standar, tetapi mereka berbeda dalam tanda nilainya, saya.e. Nilai potensi oksidasi standar adalah nilai negatif dari potensi reduksi standar. Kita dapat menulis potensi oksidasi sebagai setengah reaksi. Formula umum untuk reaksi oksidasi dan potensi oksidasi untuk tembaga diberikan di bawah ini:

Setengah reaksi oksidasi tembaga: Cu(S) ⟶ Cu2+ + 2e-
Nilai untuk potensi oksidasi standar untuk reaksi di atas (oksidasi tembaga) adalah -0.34 v.
Apa itu potensi pengurangan
Potensi reduksi adalah kecenderungan spesies kimia tertentu untuk mengalami pengurangan. Itu berarti; Spesies kimia khusus ini bersedia menerima elektron dari luar (untuk dikurangi). Diukur dalam volt dan biasanya diukur dalam kondisi standar. Oleh karena itu, kita dapat menyebutkannya sebagai potensi pengurangan standar. Denotasi untuk istilah ini adalah SRP. Kita dapat menulisnya dalam bentuk pengurangan setengah reaksi. Rumus umum dan tembaga sebagai contoh diberikan di bawah ini:

Setengah reaksi pengurangan tembaga: Cu2+ + 2e- ⟶ Cu(S)
Nilai untuk potensi reduksi standar untuk reaksi di atas (reduksi tembaga) adalah 0.34 V, yang merupakan nilai yang tepat, tetapi tanda yang berlawanan dari potensi oksidasi dari spesies kimia yang sama, tembaga. Oleh karena itu, kita dapat mengembangkan hubungan antara potensi oksidasi dan reduksi standar sebagai berikut:
E00(Srp) = -e00(SOP)
Apa perbedaan antara potensi oksidasi dan potensi reduksi?
Potensi oksidasi dan potensi reduksi adalah dua jenis nilai potensial elektroda untuk spesies kimia yang diberikan dalam volt pada kondisi standar. Perbedaan utama antara potensi oksidasi dan potensi reduksi adalah bahwa potensi oksidasi menunjukkan kecenderungan elemen kimia yang dioksidasi, sedangkan potensi reduksi menunjukkan kecenderungan elemen kimia yang akan dikurangi. Karena nilai -nilai potensial ini diukur pada kondisi standar, kita harus menyebutkannya sebagai potensi oksidasi standar dan potensi reduksi standar.
Selain itu, kami menunjukkan mereka sebagai SOP dan SRP. Selain itu, ada hubungan antara kedua istilah ini; Potensi oksidasi standar adalah nilai yang sama persis tetapi dengan tanda yang berbeda dari potensi reduksi standar.
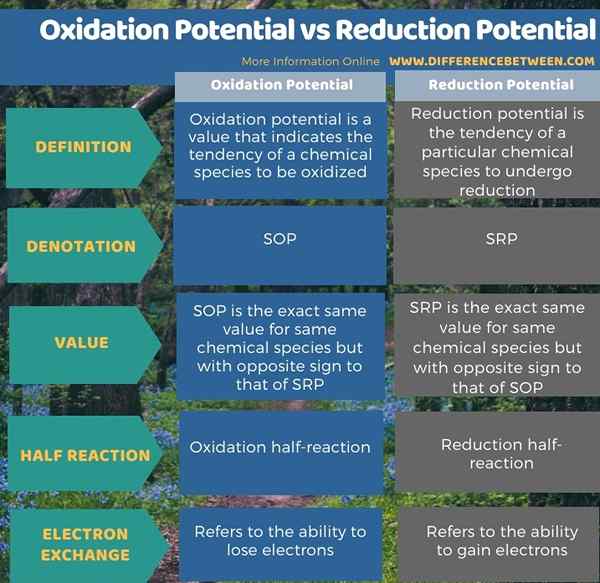
Infografis di bawah ini merangkum perbedaan antara potensi oksidasi dan potensi reduksi.

Ringkasan -Potensi Potensi Oksidasi VS Reduksi
Potensi oksidasi dan potensi reduksi adalah dua jenis nilai potensial elektroda untuk spesies kimia yang diberikan dalam volt pada kondisi standar. Perbedaan utama antara potensi oksidasi dan potensi reduksi adalah bahwa potensi oksidasi menunjukkan kecenderungan elemen kimia yang dioksidasi, sedangkan potensi reduksi menunjukkan kecenderungan elemen kimia yang akan dikurangi.
Referensi:
1. “Potensi Pengurangan Standar”. Libreteks Kimia, 2019, tersedia di sini.


