Perbedaan antara elemen perwakilan dan transisi
Perbedaan Utama - Perwakilan vs elemen transisi
Tabel elemen periodik adalah pengaturan tabel dari semua elemen kimia yang diketahui berdasarkan angka atomnya. Ada baris atau periode dan kolom atau kelompok dalam tabel periodik. Ada tren periodik di tabel periodik. Semua elemen dalam tabel periodik dapat dibagi menjadi dua kelompok sebagai elemen representatif dan elemen transisi. Itu perbedaan utama antara elemen representatif dan elemen transisi adalah itu Elemen yang representatif adalah elemen kimia dalam kelompok 1, kelompok 2 dan dalam kelompok dari 13 hingga 18 sedangkan elemen transisi adalah elemen kimia pada kelompok 3 ke kelompok 12 termasuk lantanida dan aktinida.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elemen representatif
3. Apa itu elemen transisi
4. Perbandingan berdampingan - elemen transisi representatif vs dalam bentuk tabel
5. Ringkasan
Apa itu elemen representatif?
Elemen Perwakilan adalah elemen kimia di Grup 1, Grup 2 dan dalam kelompok dari 13 hingga 18. Elemen representatif juga dikenal sebagai "elemen grup A" atau "elemen blok dan p blok" atau "elemen kelompok utama", yang berarti elemen representatif mencakup kelompok elemen kimia berikut;
-
Elemen blok S (logam alkali dan logam bumi alkali)
Elemen blok S memiliki elektron valensi di orbital S terluar dan dalam dua jenis sebagai logam alkali dan logam tanah alkali bersama dengan hidrogen dan helium. Logam alkali adalah elemen kelompok 1 (tidak termasuk hidrogen) sedangkan logam tanah alkali adalah elemen kelompok 2. Logam -logam ini dinamai seperti itu karena mereka membentuk senyawa dasar atau alkali. Logam alkali termasuk lithium, natrium, kalium, rubidium, cesium, dan francium. Logam Bumi Alkali termasuk berilium, magnesium, kalsium, strontium, barium, dan radium.

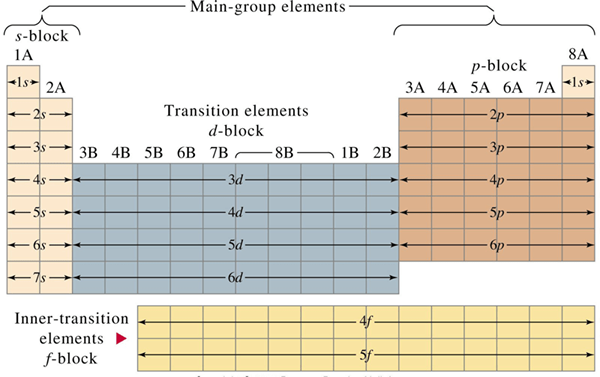
Gambar 01: Pengaturan elemen perwakilan dan transisi dalam tabel periodik
-
Elemen blok p (non -logam, halogen, gas mulia)
Elemen blok p memiliki elektron valensi di orbital P terluar. Hampir semua elemen blok P adalah non -logam, termasuk beberapa elemen metaloid (tidak termasuk helium, karena itu adalah elemen blok S). Ada tren berkala sepanjang periode dan di bawah kelompok di blok P. Metalloids termasuk boron, silikon, germanium, arsenik, antimon, dan telurium. Gas mulia adalah elemen Grup 18 (yang telah selesai eKonfigurasi Lectron). Semua yang lain adalah non -logam.
Apa itu elemen transisi?
Elemen transisi adalah elemen kimia yang memiliki elektron D yang tidak berpasangan setidaknya dalam kation stabil yang dapat terbentuk. Semua elemen transisi adalah logam. Mereka memiliki elektron valensi mereka di orbital terlarang. Oleh karena itu, semua elemen kimia dari kelompok 3 ke kelompok 12 adalah logam transisi tidak termasuk seng (karena seng tidak memiliki elektron dan zn yang tidak berpasangan+2 juga tidak memiliki elektron yang tidak berpasangan. Zn+2 adalah satu -satunya kation seng yang stabil).
Hampir semua logam transisi memiliki beberapa keadaan oksidasi stabil dalam senyawa yang berbeda. Semua senyawa ini sangat berwarna. Dan juga, keterangan yang mengandung elemen transisi yang sama dengan keadaan oksidasi yang berbeda dapat memiliki warna yang berbeda berdasarkan keadaan oksidasi (warna kation bervariasi dengan keadaan oksidasi dari elemen kimia yang sama). Alasan warna ini adalah adanya elektron D yang tidak berpasangan (memungkinkan elektron untuk melompat dari satu orbital ke orbital lainnya dengan menyerap energi. Ketika elektron -elektron ini kembali ke orbital sebelumnya, ia memancarkan energi yang diserap sebagai cahaya yang terlihat).
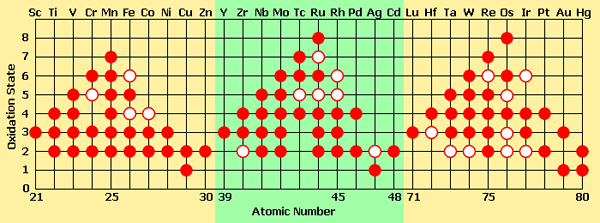
Gambar 02: keadaan oksidasi yang berbeda yang dibentuk oleh logam transisi
Lanthanides dan Actinides juga dinamai "logam transisi dalam" karena elektron valensi mereka berada di orbital f shell elektron kedua dari belakang. Elemen -elemen ini dapat dilihat di blok F dari tabel periodik.
Apa perbedaan antara elemen perwakilan dan transisi?
Elemen transisi perwakilan vs | |
| Elemen Perwakilan adalah elemen kimia di Grup 1, Grup 2 dan dalam kelompok dari 13 hingga 18. | Elemen transisi adalah elemen kimia yang memiliki elektron D yang tidak berpasangan setidaknya dalam kation stabil yang dapat terbentuk. |
| Anggota | |
| Elemen Perwakilan termasuk elemen blok S dan P Blok. | Elemen transisi termasuk elemen blok dan blok f. |
| Kelompok | |
| Elemen perwakilan berada di grup1, kelompok 2, dan dalam kelompok 13 hingga 18. | Elemen transisi ada dalam kelompok 3 hingga 12. |
| Warna | |
| Sebagian besar senyawa yang dibentuk oleh elemen representatif tidak berwarna. | Semua senyawa yang dibentuk oleh elemen transisi berwarna -warni. |
Ringkasan -Perwakilan vs elemen transisi
Elemen representatif adalah elemen kelompok utama yang mencakup logam alkali, logam tanah alkali, non -logam dan gas mulia. Logam transisi berada di blok D dan blok F dari tabel periodik. Perbedaan antara elemen representatif dan elemen transisi adalah bahwa, unsur -unsur yang representatif adalah elemen kimia dalam kelompok 1, kelompok 2 dan dalam kelompok dari 13 hingga 18 sedangkan elemen transisi adalah elemen kimia dalam kelompok 3 hingga kelompok 12 termasuk lantanida dan actinides.
Referensi:
1.“Definisi elemen representatif.”Sciencing, tersedia di sini
2.“Logam transisi.”Wikipedia, Wikimedia Foundation, 25 Feb. 2018. Tersedia disini
3.“Elemen Perwakilan dan Transisi;) - Dek Haiku oleh Jade Bailey.“Haiku Deck: Perangkat Lunak Presentasi dan Alat Presentasi Online. Tersedia disini
Gambar milik:
1.'Ptable Struktur'By SCH0013R, (CC BY-SA 3.0) Via Commons Wikimedia
2.'Transisi Oksidasi Logam Status 2'oleh tidak ada penulis yang dapat dibaca mesin yang disediakan. Felix Wan diasumsikan (berdasarkan klaim hak cipta). (CC BY-SA 3.0) Via Commons Wikimedia


