Perbedaan antara formula Rydberg dan Balmer

Itu perbedaan utama Antara formula Rydberg dan Balmer adalah itu Rumus Rydberg memberikan panjang gelombang dalam hal jumlah atom atom sedangkan rumus Balmer memberikan panjang gelombang dalam hal dua bilangan bulat - m dan n.
Rumus Rydberg dan Balmer penting dalam menentukan panjang gelombang foton yang dipancarkan dari rangsangan elektron. Rumus ini dikembangkan untuk spektrum atom hidrogen. Oleh karena itu, formula ini digunakan dengan model bohr.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu formula Rydberg
3. Apa itu Formula Balmer
4. Perbandingan berdampingan - rumus Rydberg vs Balmer dalam bentuk tabel
6. Ringkasan
Apa itu formula Rydberg?
Formula Rydberg adalah ekspresi matematika yang memprediksi panjang gelombang cahaya yang dipancarkan dari rangsangan elektron dalam atom. Dengan kata lain, formula ini menemukan panjang gelombang foton yang dipancarkan ketika elektron bergerak kembali ke keadaan dasar dari keadaan tereksitasi. Formula Rydberg dikembangkan oleh fisikawan Johannes Rydberg yang berusaha untuk memperoleh hubungan matematika antara bilangan gelombang dari garis spektral yang berdekatan dari spektrum garis hidrogen. Formulanya adalah sebagai berikut:
1/λ = rz2(1/n12-1/n22)
Di mana, λ panjang gelombang foton yang dipancarkan, r adalah konstanta rydberg, z adalah jumlah atom atom yang sedang dipertimbangkan, dan n1 dan N2 adalah bilangan bulat. Selalu n1 < n2. Kemudian, ditemukan bahwa kedua bilangan bulat ini terkait dengan angka kuantum utama, yang terlibat dalam emisi foton.
Namun, formula ini berlaku dengan atom hidrogen dan beberapa atom kecil lainnya. Tapi, ketika datang ke atom besar dan rumit, formula Rydberg memberikan hasil yang salah karena efek skrining yang muncul karena adanya beberapa elektron (elektron dalam disaring dari elektron luar).
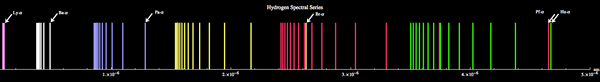
Gambar 01: Spektrum Hidrogen
Apalagi dengan menetapkan nilai yang berbeda ke n1 dan N2 Integers, kita bisa mendapatkan panjang gelombang yang sesuai dengan seri garis yang berbeda seperti Seri Lyman, Seri Balmer, Seri Paschen, dll. Saat memecahkan masalah mengenai rumus Rydberg, kita harus menggunakan nilai -nilai angka kuantum utama untuk n1 dan N2. Sejak n1 < n2, N1 adalah jumlah kuantum dari tingkat energi tempat elektron bergerak sementara n2 adalah jumlah kuantum tingkat energi dari mana elektron tereksitasi dilepaskan.
Apa itu Formula Balmer?
Formula Balmer adalah ekspresi matematika yang dapat digunakan untuk menentukan panjang gelombang dari empat garis yang terlihat dari spektrum garis hidrogen. Formula ini dikembangkan oleh fisikawan Johann Jacob Balmer pada tahun 1885. Dia mengembangkan formula ini menggunakan dua bilangan bulat: m dan n. Formulanya adalah sebagai berikut:
λ = konstan (m2/M2-N2)
Namun, formula ini sepenuhnya empiris. Itu berarti; itu bukan formula yang berasal dari teori tertentu. Selain itu, formula Balmer benar, tetapi pada saat pengembangannya, ada lebih sedikit data eksperimental untuk membuktikan bahwa itu adalah formula yang benar. Kemudian, fisikawan lain bernama Rydberg memodifikasi formula ini, yang menyatakan bahwa formula Balmer memiliki penerapan yang luas, memperkenalkan konsep bilangan gelombang alih -alih panjang gelombang.
Apa perbedaan antara rumus Rydberg dan Balmer?
Formula Rydberg dan Balmer adalah formula penting dalam kimia. Sebenarnya, formula Rydberg adalah turunan dari formula Balmer. Selain itu, perbedaan utama antara rumus Rydberg dan Balmer adalah bahwa rumus Rydberg memberikan panjang gelombang dalam hal jumlah atom atom, tetapi formula Balmer memberikan panjang gelombang dalam hal dua bilangan bulat: M dan N.
Infografis di bawah ini merangkum perbedaan antara formula Rydberg dan Balmer.

Ringkasan -Formula Rydberg vs Balmer
Formula Rydberg dan Balmer adalah formula penting dalam kimia. Formula Rydberg adalah turunan dari formula Balmer. Perbedaan utama antara rumus Rydberg dan Balmer adalah bahwa rumus Rydberg memberikan panjang gelombang dalam hal jumlah atom atom, tetapi formula Balmer memberikan panjang gelombang dalam hal dua bilangan bulat, M dan N.
Referensi:
1. Helmenstine, Todd. “Apa formula Rydberg dan bagaimana cara kerjanya?"Thoughtco, Aug. 28, 2019, tersedia di sini.
Gambar milik:
1. "Hydrogenspectrum" oleh Caitlin Jo Ramsey - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


