Perbedaan antara jembatan garam dan ikatan hidrogen
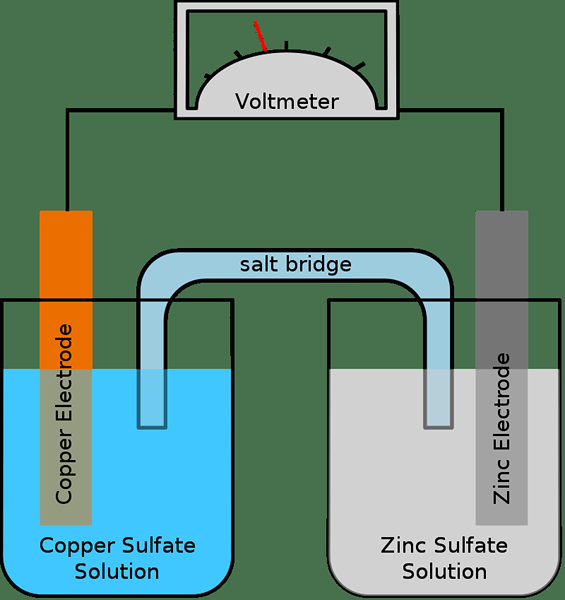
Itu perbedaan utama Antara jembatan garam dan ikatan hidrogen adalah itu Jembatan garam adalah tabung dengan elektrolit yang menghubungkan dua sel setengah dalam sel elektrokimia, sedangkan ikatan hidrogen adalah gaya tarik antara dua atom dari dua molekul yang berbeda.
Jembatan garam sangat berguna dalam mempertahankan konektivitas antara dua sel setengah dari sel elektrokimia. Itu terlihat oleh mata telanjang. Namun, ikatan hidrogen adalah ikatan kimia yang mempertahankan konektivitas antara dua molekul, yang dapat membentuk ikatan hidrogen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu jembatan garam
3. Apa itu ikatan hidrogen
4. Perbandingan Berdampingan - Jembatan Garam vs Ikatan Hidrogen Dalam Bentuk Tabel
5. Ringkasan
Apa itu jembatan garam?
Jembatan garam adalah tabung yang mengandung elektrolit (biasanya dalam bentuk gel), memberikan kontak listrik antara dua solusi. Oleh karena itu, tabung ini penting dalam menghubungkan reaksi oksidasi dan reduksi sel galvanik. Tujuan menggunakan jembatan garam adalah untuk memfasilitasi reaksi elektrokimia yang mencapai keseimbangan dengan cepat. Jika tidak ada jembatan garam, maka satu sel setengah akan mengumpulkan muatan positif, dan setengah sel lainnya mengumpulkan muatan negatif. Akibatnya, pembentukan listrik berhenti.
Ada dua jenis utama jembatan garam: jembatan tabung kaca dan jembatan kertas filter. Jembatan garam tabung kaca adalah tabung-U yang terbuat dari kaca dan mengandung elektrolit. Di jembatan garam kertas saring, ada kertas saring yang direndam dengan elektrolit.
Apa itu ikatan hidrogen?
Ikatan hidrogen adalah jenis gaya tarik antara dua atom dari dua molekul yang berbeda. Itu adalah gaya tarik yang lemah. Tetapi, bila dibandingkan dengan jenis kekuatan intramolekul lainnya seperti interaksi polar-polar, interaksi nonpolar-nonpolar seperti gaya vander waal, ikatan hidrogen lebih kuat.
Biasanya, ikatan hidrogen terbentuk antara molekul kovalen kutub. Molekul -molekul ini mengandung ikatan kovalen kutub, yang terbentuk sebagai akibat dari perbedaan nilai elektronegativitas atom yang berada dalam ikatan kovalen. Jika perbedaan ini tinggi, atom yang sangat elektronegatif cenderung menarik elektron ikatan ke arah dirinya sendiri. Dengan demikian, ini menciptakan momen dipol di mana atom yang sangat elektronegatif ini mendapatkan muatan negatif parsial, sedangkan atom lainnya mendapatkan muatan positif parsial. Kemudian ikatan menjadi ikatan kovalen kutub. Ketika molekul ini memenuhi molekul lain yang memiliki momen dipol seperti ini, muatan negatif dan positif cenderung saling menarik. Dan, gaya tarik ini disebut ikatan hidrogen.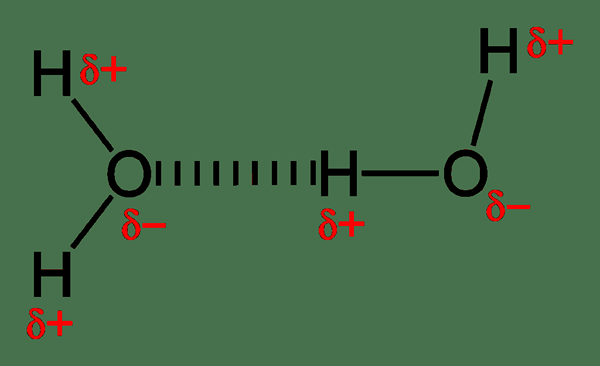
Selain itu, ikatan hidrogen terbentuk antara atom yang sangat elektronegatif dan lebih sedikit atom elektronegatif. Lebih lanjut, mereka ada ketika kita memiliki O, N, dan F dalam satu molekul dan HIMPED HIDE HIDE DI MOLECULE LAIN. Itu karena f, n, dan o adalah atom paling elektronegatif yang mampu membentuk ikatan hidrogen.
Apa perbedaan antara jembatan garam dan ikatan hidrogen?
Jembatan garam dan ikatan hidrogen penting dalam konektivitas yang berkaitan antara objek yang diinginkan. Misalnya, jembatan garam menghubungkan dua sel setengah dari sel elektrokimia, sedangkan ikatan hidrogen menghubungkan dua molekul. Perbedaan utama antara jembatan garam dan ikatan hidrogen adalah bahwa jembatan garam adalah tabung dengan elektrolit yang menghubungkan dua sel setengah dalam sel elektrokimia. Tapi, ikatan hidrogen adalah gaya tarik antara dua atom dari dua molekul yang berbeda.
Di bawah infografis merangkum perbedaan antara jembatan garam dan ikatan hidrogen.

Ringkasan -Jembatan garam vs ikatan hidrogen
Jembatan garam dan ikatan hidrogen penting dalam mempertahankan konektivitas antara benda yang diinginkan. Misalnya, jembatan garam menghubungkan dua sel setengah dari sel elektrokimia, sedangkan ikatan hidrogen menghubungkan dua molekul. Perbedaan utama antara jembatan garam dan ikatan hidrogen adalah bahwa jembatan garam adalah tabung yang terdiri dari elektrolit, dan menghubungkan dua sel setengah dalam sel elektrokimia, sedangkan ikatan hidrogen adalah gaya tarik antara dua atom dari dua molekul yang berbeda.
Referensi:
1. Helmenstine, Anne Marie. “Definisi jembatan garam."Thoughtco, Jul. 3, 2019, tersedia di sini.
Gambar milik:
1. "Galvanic Cell" oleh Gringer - File: Galvanische Zelle.PNG, oleh Tinux (CC BY-SA 3.0) Via Commons Wikimedia
2. “Hidrogen-Bonding-in-Water-2D” (Domain Publik) via Commons Wikimedia


