Perbedaan antara larutan jenuh dan terkonsentrasi
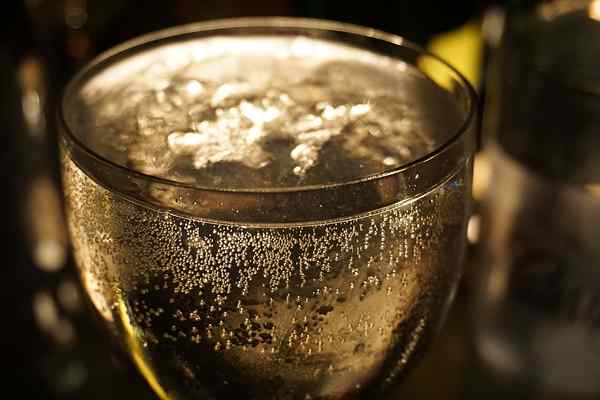
Perbedaan utama - jenuh vs Kesombonganntrasi Larutan
Solusi adalah fase cair materi yang dibentuk dengan melarutkan zat terlarut dalam pelarut. Solusi dapat dikonversi menjadi larutan jenuh dengan menambahkan lebih banyak zat terlarut sampai tidak ada lagi zat terlarut yang dapat dibubarkan. Solusi terkonsentrasi mengandung jumlah zat terlarut yang sangat tinggi, tetapi jumlah itu bukan maksimum. Itu perbedaan utama Antara larutan jenuh dan terkonsentrasi adalah itu Zat terlarut tambahan tidak dapat dilarutkan dalam larutan jenuh karena mengandung jumlah maksimum zat terlarut sedangkan zat terlarut tambahan dapat dilarutkan dalam larutan terkonsentrasi karena tidak mengandung jumlah maksimum zat terlarut (tidak jenuh dengan zat terlarut).
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu solusi jenuh
3. Apa itu solusi terkonsentrasi
4. Kesamaan antara larutan jenuh dan terkonsentrasi
5. Perbandingan berdampingan - larutan jenuh vs terkonsentrasi dalam bentuk tabel
6. Ringkasan
Apa itu solusi jenuh?
Larutan jenuh adalah larutan kimia yang mengandung konsentrasi maksimum zat terlarut yang dilarutkan dalam pelarut. Zat terlarut tambahan tidak dapat dilarutkan dalam larutan jenuh karena mengandung jumlah maksimum zat terlarut. Bentuk yang berlawanan dari larutan jenuh adalah larutan tak jenuh. Solusi tak jenuh tidak jenuh dengan zat terlarut. Larutan tak jenuh dapat berupa larutan terkonsentrasi atau larutan encer.
Ada beberapa faktor yang mempengaruhi saturasi larutan. Faktor -faktor ini mempengaruhi pembubaran zat terlarut dalam pelarut.
- Suhu - Kelarutan senyawa padat meningkat dengan meningkatkan suhu pelarut. Oleh karena itu, lebih banyak zat terlarut dapat dilarutkan dalam pelarut panas daripada dalam pelarut dingin.
- Tekanan - Lebih banyak zat terlarut dapat menjadi kekuatan untuk larut dalam pelarut dengan memberikan tekanan. Oleh karena itu, pembubaran zat terlarut dapat ditingkatkan dengan meningkatkan tekanan sistem. Mis: Gas.
- Komposisi Kimia - Jika beberapa zat terlarut lainnya sudah ada dalam larutan, itu mempengaruhi kelarutan zat terlarut.
Solusi jenuh dapat diproduksi dengan menambahkan zat terlarut ke pelarut sampai tidak ada lagi zat terlarut yang larut. Atau yang lain, itu dapat dilakukan dengan menguapkan pelarut larutan sampai zat terlarut mulai membentuk kristal. Metode lain, meskipun tidak terlalu umum adalah menambahkan benih kristal ke dalam larutan tak jenuh. Larutan jenuh super mengandung banyak zat terlarut yang tetap larut bahkan jika solusinya didinginkan. Saat biji kristal ditambahkan ke larutan jenuh ini, zat terlarut mulai mengkristal, memberikan larutan jenuh.
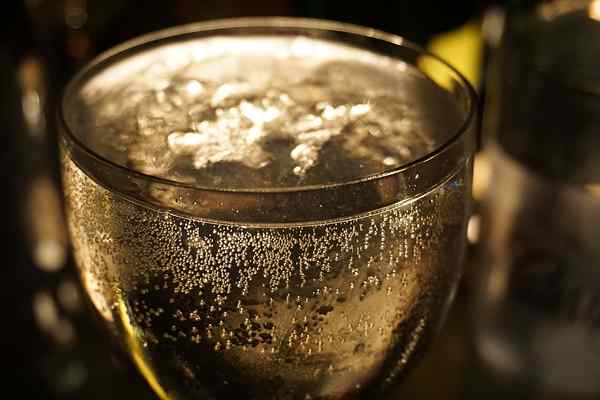
Gambar 01: Jus berkilau adalah solusi jenuh
Beberapa contoh larutan jenuh termasuk air berkarbonasi (jenuh dengan karbon), larutan gula jenuh (tidak ada lagi gula yang dapat dilarutkan), bir atau jus berkilau jenuh dengan karbon dioksida, dll.
Apa itu solusi terkonsentrasi?
Larutan terkonsentrasi adalah larutan kimia yang mengandung jumlah tinggi zat terlarut dalam pelarut. Zat terlarut tambahan dapat dilarutkan dalam larutan terkonsentrasi karena tidak mengandung jumlah maksimum zat terlarut (tidak jenuh dengan zat terlarut). Bentuk yang berlawanan dari larutan terkonsentrasi adalah larutan encer. Larutan encer mengandung jumlah zat terlarut yang relatif rendah dalam pelarut.

Gambar 02: Larutan terkonsentrasi (kanan) memiliki warna yang kuat dibandingkan dengan larutan encer (kiri)
Larutan asam atau basa terkonsentrasi diakui sebagai asam yang kuat atau basa yang kuat. Sebaliknya, asam encer atau basa adalah asam atau basa lemah. Istilah terkonsentrasi digunakan untuk memberikan ide kuantitatif tentang solusi. Larutan terkonsentrasi dapat dibentuk dengan melarutkan lebih banyak zat terlarut ke dalam larutan atau dengan menguap larutan sampai sejumlah besar pelarut diuapkan meninggalkan zat terlarut dalam larutan. Konsentrasi larutan dapat diberikan seperti di bawah ini. Di sana konsentrasi diberikan oleh unit mol/L.
Konsentrasi = jumlah mol zat terlarut / volume larutan
Apa kesamaan antara larutan jenuh dan terkonsentrasi?
- Solusi jenuh dan terkonsentrasi adalah larutan yang mengandung zat terlarut dalam jumlah tinggi
- Istilah solusi jenuh dan terkonsentrasi mengekspresikan ide kuantitatif tentang solusi.
Apa perbedaan antara larutan jenuh dan terkonsentrasi?
Larutan jenuh vs terkonsentrasi | |
| Larutan jenuh adalah larutan kimia yang mengandung konsentrasi maksimum zat terlarut yang dilarutkan dalam pelarut. | Larutan terkonsentrasi adalah larutan kimia yang mengandung jumlah tinggi zat terlarut dalam pelarut. |
| Jumlah zat terlarut | |
| Solusi jenuh mengandung jumlah maksimum zat terlarut yang dapat dipegangnya. | Larutan terkonsentrasi mengandung jumlah zat terlarut yang sangat tinggi. |
| Penambahan lebih banyak zat terlarut | |
| Zat terlarut tambahan tidak dapat dilarutkan dalam larutan jenuh karena mengandung maksimum. | Zat terlarut tambahan dapat dilarutkan dalam larutan terkonsentrasi karena tidak mengandung jumlah maksimum zat terlarut (tidak jenuh dengan zat terlarut). |
| Bentuk yang berlawanan | |
| Bentuk yang berlawanan dari larutan jenuh adalah larutan tak jenuh. | Bentuk yang berlawanan dari larutan terkonsentrasi adalah larutan encer. |
| Contoh | |
| Beberapa contoh larutan jenuh termasuk air berkarbonasi, larutan gula jenuh, bir atau jus berkilau jenuh dengan karbon dioksida, dll. | Beberapa contoh larutan terkonsentrasi termasuk asam pekat dan basa terkonsentrasi yang digunakan di laboratorium. |
Ringkasan -jenuh vs Kesombonganntrasi Larutan
Solusi jenuh adalah bentuk larutan terkonsentrasi, tetapi mengandung jumlah maksimum zat terlarut yang dapat ditahan. Perbedaan antara larutan jenuh dan terkonsentrasi adalah bahwa zat terlarut tambahan tidak dapat dilarutkan dalam larutan jenuh karena mengandung jumlah maksimum zat terlarut sedangkan zat terlarut dapat dilarutkan dalam larutan terkonsentrasi karena tidak mengandung jumlah zat terlarut (tidak jenuh dengan zat terlarut).
Referensi:
1.“13.2: Solusi dan kelarutan jenuh.”Kimia Libretexts, Libretexts, 8 Okt. 2017. Tersedia disini
2.“Cara memusatkan larutan.“Ilmu Pengetahuan. Tersedia disini
3.Helmenstine, Anne Marie, D. “Definisi dan contoh solusi jenuh."Thoughtco, Jun. 20, 2017. Tersedia disini
Gambar milik:
1.'2980956' oleh Nicole_80 (domain publik) melalui Pixabay
2.'Riboflavinsolution'by Sbharris - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


