Perbedaan antara pelarut dan zat terlarut

Itu perbedaan utama antara pelarut dan zat terlarut adalah bahwa Solute adalah orang yang harus dibubarkan sementara, pelarut bertanggung jawab untuk melarutkannya.
Solusi adalah campuran homogen dari dua atau lebih zat. Kami menyebutkannya campuran yang homogen karena komposisinya seragam di seluruh larutan. Juga, komponen solusi terutama dari dua jenis, zat terlarut dan pelarut. Pelarut melarutkan zat terlarut dan membentuk larutan yang seragam. Jadi, jumlah pelarut biasanya lebih tinggi dari jumlah zat terlarut.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu pelarut
3. Apa itu zat terlarut
4. Perbandingan berdampingan - pelarut vs zat terlarut dalam bentuk tabel
5. Ringkasan
Apa itu pelarut?
Pelarut adalah zat dengan kemampuan melarutkan. Dengan demikian, ia dapat melarutkan zat lain. Juga, pelarut dapat terjadi dalam keadaan cair, gas atau padat. Namun, paling umum, kami menggunakan cairan sebagai pelarut. Selain itu, di antara cairan, air adalah umum sebagai pelarut universal, karena dapat melarutkan banyak zat daripada pelarut lainnya. Selain itu, kita dapat melarutkan gas, padatan, atau zat terlarut cair lainnya dalam pelarut cair. Tapi, dalam pelarut gas, hanya zat terlarut gas yang akan larut.

Gambar 01: Asam asetat berguna sebagai pelarut organik
Selain itu, ada batasan jumlah zat terlarut yang dapat kami tambahkan ke sejumlah pelarut tertentu. Kami mengatakan solusinya menjadi jenuh jika kami telah menambahkan jumlah maksimum zat terlarut ke pelarut. Ada pelarut dalam dua jenis sebagai pelarut organik atau anorganik. Misalnya, eter, heksana, dan metilen klorida adalah pelarut organik, sedangkan air adalah pelarut anorganik.
Pelarut kutub dan non-polar
Ada dua kategori pelarut yang luas sebagai pelarut kutub dan pelarut non-polar.
Pelarut kutub Oleh karena itu, molekul memiliki pemisahan muatan. Dalam proses pembubaran, interaksi dipol-dipol atau interaksi dipol yang diinduksi dipol dapat terjadi. Kita selanjutnya dapat membagi pelarut kutub sebagai pelarut aprotik protik dan kutub kutub. Pelarut protik polar mampu pembentukan ikatan hidrogen dengan zat terlarut. Oleh karena itu, mereka melarutkan anion dengan ikatan hidrogen. Air dan metanol adalah pelarut protik polar. Pelarut aprotik polar tidak dapat membentuk ikatan hidrogen. Namun, mereka memiliki momen dipol yang besar, karenanya membentuk interaksi dipol-dipol dengan zat terlarut ionik, oleh karena itu, melarutkannya. Aseton adalah pelarut aprotik polar.
Pelarut non polar Larutkan zat terlarut non polar. Heksana, benzena, dan toluena adalah beberapa pelarut non-polar yang umum.
Selain pelarut yang diklasifikasi di atas, ada beberapa pelarut, yang memiliki sifat polar dan non-polar menengah. Menurut fenomena “Like Dissolve Like”, pelarut larut terlarut, yang cocok dengan mereka.
Properti
Sifat pelarut sangat penting untuk diketahui kapan kita menggunakannya di laboratorium. Misalnya, mengetahui titik -titik mendidih pelarut membantu kita menentukan cara menggunakan metode distilasi untuk memisahkannya. Atau, kepadatan pelarut penting dalam teknik ekstraksi pelarut. Volatilitas, toksisitas, dan kemampuan terbakar adalah beberapa parameter lainnya, yang harus kami fokuskan ketika kami bekerja dengan pelarut yang berbeda.
Apa itu zat terlarut?
Solut adalah zat yang larut dalam pelarut untuk membentuk solusi. Zat terlarut dapat terjadi dalam fase cair, gas atau padat. Biasanya, dalam solusi, zat terlarut dalam jumlah yang lebih rendah dari pelarut.

Gambar 02: Air garam mengandung garam sebagai zat terlarut
Ketika suatu solusi memiliki jumlah maksimum zat terlarut yang dapat larut, maka kami mengatakan solusinya menjadi jenuh. Pembubaran zat terlarut dalam pelarut mengubah sifat -sifat pelarut.
Apa perbedaan antara pelarut dan zat terlarut?
Pelarut adalah zat dengan kemampuan melarutkan, sehingga dapat melarutkan zat lain sedangkan zat terlarut adalah zat yang larut dalam pelarut untuk membentuk larutan. Ini adalah perbedaan utama antara pelarut dan zat terlarut. Selain itu, ada beberapa perbedaan lain antara pelarut dan zat terlarut dalam keadaan fisik mereka, kelarutan dan titik didih. Misalnya, mengingat titik didih, titik didih dari zat terlarut biasanya lebih tinggi dari pada pelarut.
Infografis di bawah ini menunjukkan detail lebih lanjut tentang perbedaan antara pelarut dan zat terlarut.
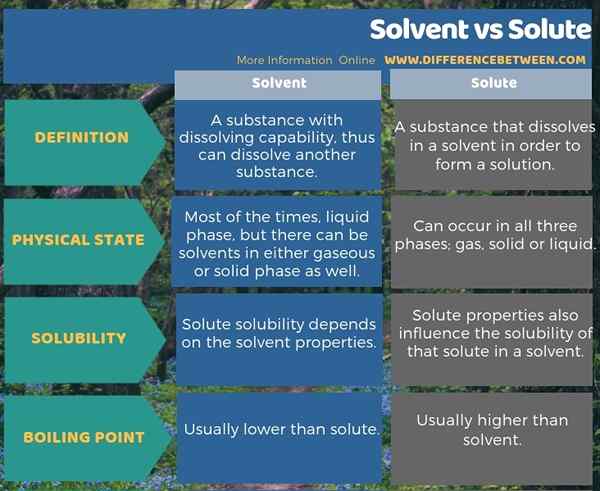
Ringkasan -pelarut vs zat terlarut
Zat terlarut adalah zat yang larut dalam pelarut untuk membentuk solusi. Oleh karena itu, perbedaan antara pelarut dan zat terlarut adalah bahwa zat terlarut adalah orang yang harus dilarutkan, dan pelarut bertanggung jawab untuk melarutkannya.
Referensi:
1. "Pelarut.”Wikipedia, Wikimedia Foundation, 6 September. 2018. Tersedia disini
2. "Larutan.”Wikipedia, Wikimedia Foundation, 21 September. 2018. Tersedia disini
Gambar milik:
1."Asam Asetat" oleh W. Oelen (CC BY-SA 3.0) Via Commons Wikimedia
2."SaltinwaterSolutionliquid" oleh Chris 73 (CC BY-SA 3.0) Via Commons Wikimedia


