Perbedaan antara konformasi yang terhuyung -huyung dan dikalahkan
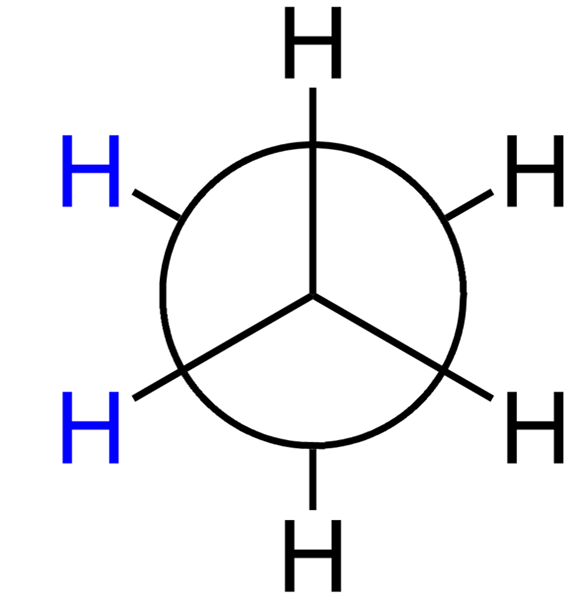
Perbedaan utama - konformasi yang terhuyung -huyung
Dua istilah, konformasi yang terhuyung -huyung dan dikalahkan (dua cabang utama dari proyeksi Newmann) digunakan dalam kimia organik untuk menjelaskan pengaturan atom dalam beberapa molekul organik. Dalam hal stabilitas, Konformasi terhuyung lebih stabil daripada formasi yang dikalahkan. Pembentukan konfirmasi yang terhuyung -huyung lebih menguntungkan karena energi konformasi minimum. Ini adalah perbedaan utama antara konformasi terhuyung -huyung dan dikalahkan.
Apa konformasi terhuyung -huyung?
Konformasi terhuyung adalah konformasi kimia dari molekul seperti etana (CH3-Ch3= abcx-ydef) di mana substituen a, b, dan c dilampirkan pada jarak maksimum dari d, e, dan f. Dalam hal ini, sudut torsi adalah 60 ° dan energi konformasi minimum. Persyaratan utama untuk konfirmasi ini adalah ikatan kimia tunggal rantai terbuka untuk menghubungkan dua SP3hybridisedatoms. Beberapa molekul seperti N-butana dapat memiliki versi khusus konfirmasi yang terhuyung -huyung: gauche dan anti.
Apa konformasi yang dikalahkan?
Konformasi yang dikalahkan dapat ada di rantai terbuka apa pun ketika satu ikatan menghubungkan dua SP3atom hibridisasi. Dalam hal ini, dua substituen (katakanlah -x dan -y) pada atom yang berdekatan (katakanlah a dan b) berada dalam jarak terdekat yang terdekat. Dengan kata lain, sudut torsi x-a-b-y adalah 0 ° dalam molekul. Konfirmasi ini memiliki energi konformasi maksimum karena hambatan sterik.
Apa perbedaan antara konformasi yang terhuyung -huyung dan dikalahkan?
Struktur:
Konfirmasi terhuyung -huyung: Konfirmasi terhuyung -huyung dapat dipahami dengan baik dengan menggunakan molekul etane. Saat kita melihat dari samping, konfirmasi yang terhuyung -huyung dapat diilustrasikan sebagai berikut. 
Konformasi Eclips: Molekul etana dapat diambil sebagai salah satu contoh paling sederhana untuk memahami konformasi yang dikalahkan.Ketika kita melihat dari samping, konformasi yang dikalahkan dari molekul etana dapat dilihat sebagai berikut. 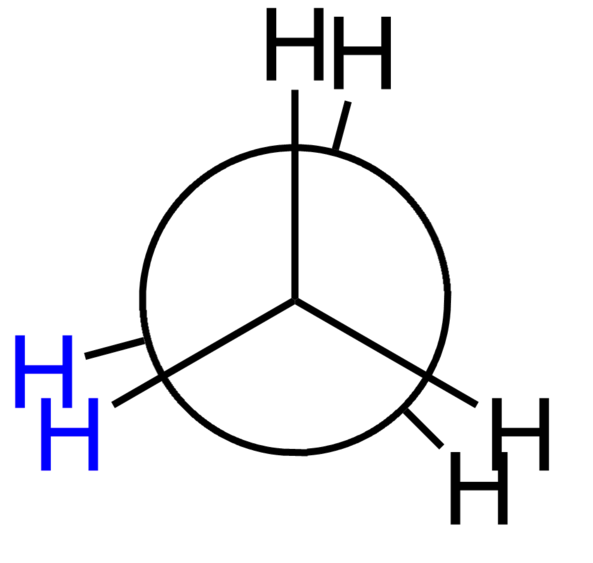
Stabilitas:
Konfirmasi terhuyung -huyung: Konfirmasi terhuyung -huyung dapat dianggap sebagai konformasi yang paling menguntungkan karena telah mengurangi regangan dalam molekul. Karena lampiran dalam molekul lebih merata dan ini mengurangi tolakan antara perlekatan karbon depan dan perlekatan karbon belakang. Selain itu, konformasi yang terhuyung -huyung distabilkan oleh hiperkonjugasi.
Konformasi Eclips: Konformasi yang dikalahkan kurang menguntungkan karena dapat memiliki lebih banyak interaksi antara substituen depan dan belakang; Ini menciptakan lebih banyak ketegangan. Sudut antara substituen depan dan belakang bisa jadi apa saja.
Energi potensial:
Grafik variasi energi potensial sebagai fungsi dari sudut dihedral (sudut dihedral antara dua hidrogen pada karbon yang berbeda) menunjukkan perbedaan energi antara konfirmasi yang terhuyung -huyung dan konfirmasi yang dikalahkan.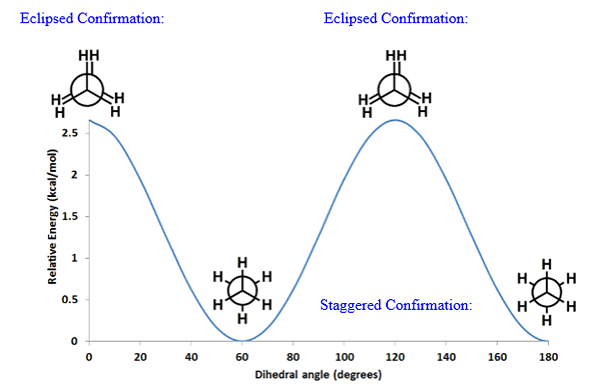
Konfirmasi terhuyung -huyung:
Plot di atas menunjukkan bahwa konformasi yang terhuyung -huyung memiliki energi potensial minimum. Ini menyiratkan bahwa ini adalah bentuk yang paling stabil dan ini bisa menjadi bentuk yang paling menguntungkan dari konfirmasi lainnya.
Konformasi Eclips:
Menurut grafik di atas, konfirmasi yang dikalahkan memiliki energi potensial maksimum. Ini menyiratkan bahwa konformasi yang dikalahkan adalah keadaan transisi dan tidak pernah ada dalam bentuk ini.
Definisi:
Konformasi:
Konformasi adalah posisi yang berbeda yang dapat diambil molekul sambil menjaga atom dan ikatan pada molekul. Dalam hal ini, satu -satunya variasi adalah sudut di mana bagian -bagian tertentu dari molekul ditekuk atau dipelintir.
Sudut torsi (sudut dihedral):
Ini merujuk pada sudut antara pesawat melalui dua set tiga atom, memiliki dua atom yang sama. Dengan kata lain, itu adalah sudut antara dua bidang yang berpotongan.
Referensi:
“Konformasi Eclipsed” (Wikipedia) dari sini “Konformasi terhuyung -huyung” (Wikipedia) dari sini “Konformasi Alkana: Rotasi Tentang Ikatan Karbon-Karbon” (Kshitij Education India) dari sini “Konformasi alkana yang lebih tinggi” (SparkNotes) dari sini “Analisis konformasi alkana” (Pengantar Kimia Organik) dari siniGambar milik:
"Newman Proyection Ethane" oleh Aglarekh di de.Wikipedia; Leyo - Pekerjaan sendiri (domain publik) melalui commons wikimedia


