Perbedaan antara elemen transuranik dan radioisotop
Itu perbedaan utama Antara elemen transuranik dan radioisotop adalah itu Elemen transuranik adalah elemen kimia yang memiliki bilangan atom lebih besar dari 92, sedangkan radioisotop adalah atom yang tidak stabil yang bersifat radioaktif.
Baik elemen transuranik dan radioisotop adalah elemen kimia radioaktif. Sebagian besar waktu, atom radioaktif memiliki jumlah atom yang tinggi, tetapi kadang -kadang bisa ada isotop langka dari beberapa elemen kimia dengan jumlah atom kecil, yang bersifat radioaktif karena ketidakseimbangan proton dan neutron dalam inti mereka.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elemen transuranic
3. Apa itu radioisotop
4. Perbandingan berdampingan - Elemen Transuranik vs Radioisotop dalam bentuk tabel
5. Ringkasan
Apa itu elemen transuranic?
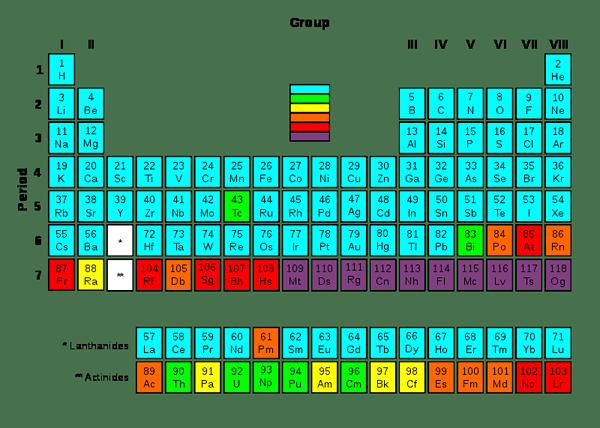
Elemen Transuranik atau Elemen Transuranium adalah elemen kimia yang memiliki jumlah atom lebih tinggi dari 92. Jumlah atom uranium adalah 92; Oleh karena itu, serangkaian elemen transuranik dimulai dengan uranium, yang memimpin nama seri ini (trans + uranium). Semua anggota daftar ini bersifat radioaktif karena sifatnya yang tidak stabil.
Sebagian besar elemen kimia dalam tabel periodik memiliki isotop yang dapat kita temukan di alam semesta sebagai atom yang stabil atau sebagai elemen kimia yang memiliki waktu paruh yang sangat panjang. Elemen kimia ini berada dalam kisaran 1 hingga 92 angka atom.

Gambar 01: Elemen Transuranik
Kami dapat menghasilkan elemen transuranik melalui menggunakan elemen sintetis, menggunakan reaktor nuklir atau menggunakan akselerator partikel. Ada hubungan antara angka atom dan paruh elemen-elemen ini. Waktu paruh umumnya berkurang dengan meningkatnya jumlah atom. Namun, mungkin ada beberapa pengecualian karena beberapa isotop; Misalnya, isotop curium dan dubnium.
Daftar Elemen Transuranik
- Actinides
- Neptunium
- Plutonium
- Americium
- Curium
- Berkelium
- Californium
- Einsteinium
- Fermium
- Mendelevium
- Nobelium
- Lawrencium
- Elemen transaktinida
- Rutherfordium
- Dubnium
- Seaborgium
- Bohrium
- Hassium
- Meitnerium
- Darmstadtium
- Roentgenium
- Copernicium
- Nihonium
- Flerovium
- Moscovium
- Livermorium
- Tennessine
- Oganesson
- Elemen dalam periode 8 (belum ditemukan)
Apa itu radioisotop?
Radioisotop adalah isotop radioaktif dari elemen kimia. Isotop ini tidak stabil karena mereka memiliki energi nuklir berlebih. Ada tiga cara agar radioisotop melepaskan energi nuklir ini:
- Sebagai radiasi gamma
- Melepaskan elektron konversi
- Emisi partikel alfa atau beta
Jika salah satu dari tiga tindakan di atas terjadi, kami mengatakan bahwa pembusukan radioaktif telah terjadi. Kami menyebutkan emisi ini sebagai radiasi pengion karena sinar yang dipancarkan ini dapat mengionisasi atom lain untuk membebaskan elektron.

Gambar 02: Americium adalah radioisotope
Semua elemen kimia mungkin ada sebagai atom radioaktif dalam bentuk isotopiknya. Misalnya, bahkan elemen paling ringan hidrogen memiliki isotop radioaktif - tritium. Selain itu, beberapa elemen kimia hanya ada sebagai elemen radioaktif.
Apa perbedaan antara elemen transuranik dan radioisotop?
Baik elemen transuranik dan radioisotop adalah elemen kimia radioaktif. Perbedaan utama antara elemen transuranik dan radioisotop adalah bahwa elemen transuranik adalah elemen kimia yang memiliki bilangan atom lebih besar dari 92, sedangkan radioisotop adalah atom yang tidak stabil yang bersifat radioaktif.
Selain itu, elemen transuranik hanya ada sebagai atom radioaktif, sedangkan radioisotop adalah isotop elemen kimia yang ada sebagai atom radioaktif. Misalnya, seri actinide, seri transaktinida dan elemen periode 8 adalah elemen transuranic. Isotop tritium hidrogen adalah radioisotop yang sangat ringan dengan jumlah atom yang sangat rendah.
Di bawah infografis merangkum perbedaan antara elemen transuranik dan radioisotop.

Ringkasan -Elemen Transuranik vs Radioisotop
Baik elemen transuranik dan radioisotop adalah elemen kimia radioaktif. Perbedaan utama antara elemen transuranik dan radioisotop adalah bahwa elemen transuranik adalah elemen kimia yang memiliki bilangan atom lebih besar dari 92, sedangkan radioisotop adalah atom yang tidak stabil yang bersifat radioaktif.
Referensi:
1. Fry, Brian. “Menggunakan pelacak isotop stabil.”Stable Isotope Ecology, 2006, PP. 40-75., doi: 10.1007/0-387-33745-8_3.
2. “Radioisotop.IAEA, IAEA, 15 Juli 2016, tersedia di sini.
Gambar milik:
1. “Radioaktivitas tabel periodik” dengan periodic_table_armtuc3.SVG: ARMTUK (Talk) Pekerjaan Derivatif: Alessio Rolleri (Talk) Pekerjaan Derivatif: Gringer (Talk) - Periodic_table_armtuk3.SVG (CC BY-SA 3.0) Via Commons Wikimedia
2. “Americium-241 sampel dari detektor asap” oleh MedicalReference-Fotografer Sendiri (CC BY-SA 3.0) Via Commons Wikimedia


