Perbedaan antara trypsin dan chymotrypsin
Perbedaan utama - trypsin vs chymotrypsin
Pencernaan Protein adalah proses yang sangat penting dalam prosedur pencernaan keseluruhan dalam organisme hidup. Protein kompleks dicerna ke dalam monomer asam amino dan diserap melalui usus kecil. Protein sangat penting karena melayani fungsional utama dan peran struktural dalam suatu organisme. Pencernaan protein terjadi melalui enzim pencernaan protein yang meliputi trypsin, chymotrypsin, peptidase, dan protease. Trypsin adalah enzim pencernaan protein yang membelah ikatan peptida pada asam amino basa yang meliputi lisin dan arginin. Chymotrypsin juga merupakan enzim pencernaan protein yang memecah ikatan peptida pada asam amino aromatik seperti fenilalanin, triptofan, dan tirosin. Itu perbedaan utama Antara trypsin dan chymotrypsin adalah posisi asam amino di mana ia terpotong dalam protein. Trypsin membelah pada posisi asam amino basa sedangkan chymotrypsin terpotong pada posisi asam amino aromatik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu trypsin
3. Apa itu chymotrypsin
4. Kesamaan antara trypsin dan chymotrypsin
5. Perbandingan berdampingan - trypsin vs chymotrypsin dalam bentuk tabel
6. Ringkasan
Apa itu trypsin?
Trypsin adalah 23.3 kDa protein milik keluarga protease serin dan substrat utamanya adalah asam amino basa. Asam amino basa ini termasuk arginin dan lisin. Trypsin ditemukan pada tahun 1876 oleh Kuhne. Trypsin adalah protein globular dan ada dalam bentuk tidak aktif yang merupakan trypsinogen - zymogen. Mekanisme aksi trypsin didasarkan pada aktivitas protease serin.
Trypsin terpotong di ujung terminal C dari asam amino basa. Ini adalah reaksi hidrolisis dan terjadi pada pH - 8.0 di usus kecil. Aktivasi trypsinogen terjadi melalui penghapusan heksapeptida terminal, dan menghasilkan bentuk aktif; trypsin. Trypsin aktif adalah dua jenis utama; α - trypsin dan β -trypsin. Mereka berbeda dalam stabilitas termal dan strukturnya. Situs aktif trypsin mengandung histidin (H63), asam aspartat (D107) dan serin (S200).
Gambar 01: trypsin
Tindakan enzimatik trypsin dihambat oleh DFP, aprotinin, AG+, Benzamidine, dan edta. Aplikasi trypsin termasuk disosiasi jaringan, trypsinization dalam kultur sel hewan, pemetaan tryptic, in vitro Studi protein, sidik jari dan aplikasi kultur jaringan.
Apa itu chymotrypsin?
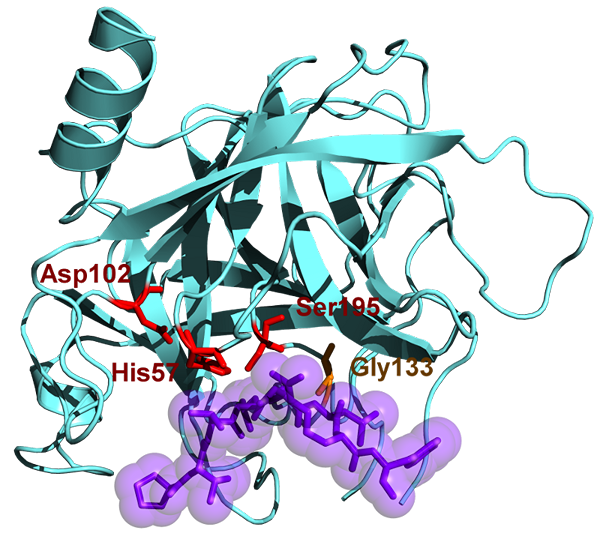
Chymotrypsin memiliki berat molekul 25.6 kDa dan milik keluarga serine protease, dan itu adalah endopeptidase. Chymotrypsin ada dalam bentuk tidak aktif yang merupakan chymotrypsinogen. Chymotrypsin ditemukan pada tahun 1900 -an. Chymotrypsin menghidrolisis ikatan peptida pada asam amino aromatik. Substrat aromatik ini termasuk tirosin, fenilalanin, dan triptofan. Substrat enzim ini terutama di L-isomer dan siap bertindak atas amida dan ester asam amino. PH optimal di mana aksi chymotrypsin adalah 7.8 - 8.0. Ada dua bentuk utama chymotrypsin seperti chymotrypsin A dan chymotrypsin B dan mereka sedikit berbeda dalam karakteristik struktural dan proteolitik yang ada. Situs aktif chymotrypsin mengandung triad katalitik dan terdiri dari histidin (H57), asam aspartat (D102) dan serin (S195).

Gambar 02: Chymotrypsin
Aktivator chymotrypsin adalah cetyltrimethylammonium bromide, dodecyltrimethylammonium bromide, hexadecyltrimethylammonium bromide dan tetrabutylammonium bromide. Inhibitor chymotrypsin adalah peptidil aldehida, asam boronat, dan turunan kumarin. Chymotrypsin digunakan secara komersial dalam sintesis peptida, pemetaan peptida dan sidik jari peptida.
Apa kesamaan antara trypsin dan chymotrypsin?
- Kedua enzim adalah protease serin.
- Kedua enzim membelah ikatan peptida.
- Kedua enzim bertindak di usus kecil.
- Kedua enzim ada dalam bentuk tidak aktif sebagai zymogens.
- Kedua enzim terdiri dari triad katalitik yang mengandung histidin, asam aspartat, dan serin di situs aktifnya.
- Kedua enzim awalnya ditemukan dan diekstraksi dari sapi.
- Produksi kedua enzim dilakukan melalui teknik DNA rekombinan saat ini.
- Kedua enzim bertindak pada pH dasar yang optimal.
- Kedua enzim digunakan in vitro di berbagai industri.
Apa perbedaan antara trypsin dan chymotrypsin?
Trypsin vs chymotrypsin | |
| Trypsin adalah enzim pencernaan protein yang akan memecah ikatan peptida pada asam amino basa seperti lisin dan arginin. | Chymotrypsin yang juga merupakan enzim pencernaan protein memotong ikatan peptida pada asam amino aromatik seperti fenilalanin, triptofan, dan tirosin. |
| Berat molekul | |
| Berat molekul trypsin adalah 23.3 k da. | Berat molekul chymotrypsin adalah 25.6 k da. |
| Substrat | |
| Protein kompleks dicerna ke dalam monomer asam amino dan diserap melalui usus kecil. | Substrat asam amino aromatik seperti tirosin, triptofan, dan fenilalanin bertindak pada chymotrypsin. |
| Bentuk enzim zymogen | |
| Trypsinogen adalah bentuk trypsin yang tidak aktif. | Chymotrypsinogen adalah bentuk chymotrypsin yang tidak aktif. |
| Aktivator | |
| Lanthanides adalah aktivator trypsin. | Cetyltrimethylammonium bromide, dodecyltrimethylammonium bromide, hexadecyltrimethylammonium bromide dan tetrabutylammonium bromide adalah aktivator chymotrypsin. |
| Inhibitor | |
| DFP, aprotinin, AG+, Benzamidine, dan EDTA adalah penghambat trypsin. | Peptidyl aldehida, asam boronat, dan turunan kumarin adalah penghambat chymotrypsin. |
Ringkasan -Trypsin vs chymotrypsin
Peptidase atau enzim proteolitik membelah protein melalui hidrolisis ikatan peptida. Trypsin membelah ikatan peptida pada asam amino basa sedangkan chymotrypsin memotong ikatan peptida pada residu asam amino aromatik. Kedua enzim adalah serine peptidase dan bertindak di usus kecil di lingkungan pH dasar. Saat ini, banyak penelitian yang terlibat dalam memproduksi trypsin dan chymotrypsin menggunakan teknologi DNA rekombinan dengan menggunakan berbagai spesies bakteri dan jamur karena enzim ini memiliki nilai industri yang tinggi. Inilah perbedaan antara trypsin dan chymotrypsin.
Unduh versi PDF dari trypsin vs chymotrypsin
Anda dapat mengunduh versi PDF artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh versi PDF di sini perbedaan antara trypsin dan chymotrypsin
Referensi:
1.“Chymotrypsin."Chymotrypsin - Manual Enzim Worthington. Tersedia disini
2.“Trypsin."Trypsin - Manual Enzim Worthington. Tersedia disini
Gambar milik:
1.'Serine Protease'by Tinastella at English Wikibooks (domain publik) via Commons Wikimedia
2.'Chymotrypsin 4cha'by Yikrazuul - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


