Apa perbedaan antara enzim alosterik dan non-allosterik
Itu perbedaan utama Antara enzim alosterik dan non-allosterik adalah bahwa enzim alosterik memiliki situs alosterik selain situs aktifnya untuk pengikatan molekul pengatur, sedangkan enzim non-allosterik hanya memiliki situs aktif untuk mengikat dengan substrat.
Ada berbagai cara regulasi enzim. Regulasi alosterik adalah salah satu bentuk regulasi enzim. Regulasi alosterik difasilitasi oleh enzim yang disebut enzim alosterik. Molekul pengatur berikatan dengan situs alosterik yang dimiliki oleh enzim dan mengatur aktivitas enzimatik. Oleh karena itu, enzim alosterik juga dikenal sebagai enzim pengatur. Keistimewaan enzim alosterik adalah bahwa mereka memiliki situs tambahan selain dari situs aktif utama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu enzim alosterik
3. Apa itu enzim non-allosterik
4. Kesamaan - enzim alosterik vs non -allosterik
5. Enzim alosterik vs non-allosterik dalam bentuk tabel
6. Ringkasan - enzim alosterik vs non -allosterik
Apa itu enzim alosterik?
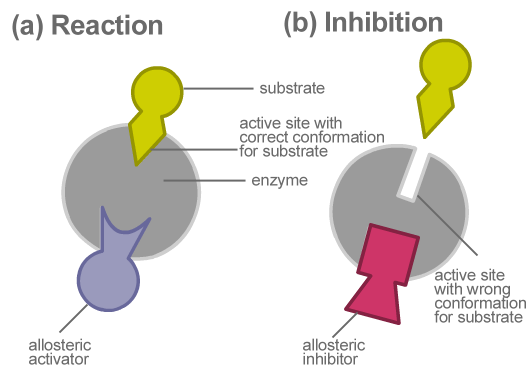
Enzim alosterik adalah jenis enzim yang memiliki situs alosterik untuk pengikatan molekul pengatur. Situs -situs ini terletak di subunit protein yang berbeda dari enzim. Molekul pengatur dapat menjadi inhibitor atau aktivator. Saat inhibitor berikatan dengan enzim, aktivitas enzim berkurang. Saat aktivator berikatan dengan enzim, fungsi enzimatik meningkat. Jenis regulasi aktivitas enzimatik ini dikenal sebagai regulasi alosterik. Enzim alosterik khusus untuk substratnya dan molekul pengaturnya (modulator). Interaksi molekul/modulator pengatur dengan enzim adalah reversibel dan non-kovalen. Reaksi yang dikatalisis oleh enzim alosterik menunjukkan kurva sigmoidal.

Gambar 01: Penghambatan Alosterik
Regulasi alosterik terjadi sebagai mekanisme umpan balik. Dalam penghambatan umpan balik negatif, molekul pengatur adalah penghambat, dan menghambat reaksi. Dalam mekanisme umpan balik positif, molekul efektor atau aktivator yang berikatan dengan situs alosterik meningkatkan laju reaksi. Ikatan modulator alosterik ke enzim alosterik mengubah konformasi protein, sehingga mempengaruhi fungsinya. Piruvat kinase, ribonucleotide reductase, aspartate transcarbamoylase dan ADP-glukosa pirofosforilase adalah beberapa contoh enzim alosterik.
Apa itu enzim non-allosterik?
Enzim non-allosterik adalah enzim yang tidak memproses situs alosterik selain dari situs aktif. Oleh karena itu, mereka adalah enzim sederhana yang hanya memiliki satu situs aktif enzim. Enzim ini adalah enzim spesifik substrat. Mereka juga enzim non-regulasi. Reaksi mereka menunjukkan kurva hiperbolik.
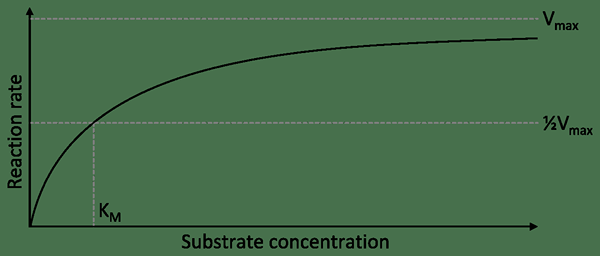
Gambar 02: Kurva hiperbolik ditunjukkan oleh enzim non-allosterik
Ketika ada inhibitor kompetitif, laju reaksi menurun. Inhibitor kompetitif mirip dengan substrat. Oleh karena itu, ia bersaing dengan substrat untuk mengikat dengan situs aktif. Ketika substrat gagal mengikat dengan situs aktif, kompleks substrat-enzim tidak dapat dibentuk, sehingga laju reaksi berkurang.
Apa kesamaan antara enzim alosterik dan non-allosterik?
- Enzim alosterik dan non-allosterik adalah dua jenis enzim.
- Mereka terdiri dari protein.
- Mereka mengkatalisasi reaksi biokimia dalam sel hidup.
- Kedua jenis enzim tetap tidak berubah di akhir reaksi.
- Konsentrasi kecil enzim ini sudah cukup untuk mengkatalisasi reaksi.
- Mereka sensitif terhadap perubahan pH dan suhu.
Apa perbedaan antara enzim alosterik dan non-allosterik?
Enzim alosterik adalah enzim yang memiliki situs tambahan yang disebut situs pengatur atau situs alosterik untuk pengikatan molekul pengatur. Enzim non-allosterik adalah enzim sederhana yang hanya memiliki situs aktif untuk pengikatan substratnya. Jadi, ini adalah perbedaan utama antara enzim alosterik dan non-allosterik.
Infografis berikut mencantumkan perbedaan antara enzim alosterik dan non-allosterik dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -enzim alosterik vs non -allosterik
Enzim alosterik adalah enzim pengatur yang memiliki situs alosterik selain situs aktif. Oleh karena itu, molekul pengatur dapat mengikat dengan situs alosterik dan mengatur aktivitas enzimatik. Sebaliknya, enzim non-allosterik tidak memiliki situs alosterik. Ini hanya memiliki situs yang aktif. Enzim non-allosterik bukan enzim pengatur. Enzim alosterik adalah substrat dan molekul regulasi spesifik, sedangkan enzim non-allosterik spesifik substrat. Dengan demikian, ini adalah ringkasan perbedaan antara enzim alosterik dan non-allosterik.
Referensi:
1. “Regulasi enzim (artikel).”Khan Academy.
2. “Enzim.”Lumen.
Gambar milik:
1. “Penghambatan Allosterik” oleh [[: en: User: 1 | 1]] di wikipedia berbahasa Inggris (CC by-sa 3.0) Via Commons Wikimedia
2. "Michaelis Menten Curve 2" oleh Thomas Shafee - karya sendiri (CC oleh 4.0) Via Commons Wikimedia


