Apa perbedaan antara elektrolit dan elektrolisis
Itu Perbedaan utama antara elektrolit dan elektrolisis adalah bahwa elektrolit adalah zat yang dapat menghasilkan ion, sedangkan elektrolisis adalah proses di mana arus listrik digunakan untuk menggerakkan reaksi kimia.
Kami terutama menggunakan istilah elektrolit dan elektrolisis dalam elektrokimia, di mana kami menyelidiki hubungan antara listrik dan kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektrolit
3. Apa itu elektrolisis
4. Elektrolit vs elektrolisis dalam bentuk tabel
5. Ringkasan - Elektrolit vs Elektrolisis
Apa itu elektrolit?
Elektrolit adalah zat yang dapat menghasilkan ion. Elektrolit menyediakan ion ketika mereka berada dalam tahap cair atau ketika mereka dilarutkan dalam pelarut (air). Ion -ion ini membuat elektrolit dapat menghantarkan listrik. Namun, ada beberapa elektrolit solid-state juga. Selain itu, beberapa gas seperti karbon dioksida menghasilkan ion (ion hidrogen dan bikarbonat) saat larut dalam air.
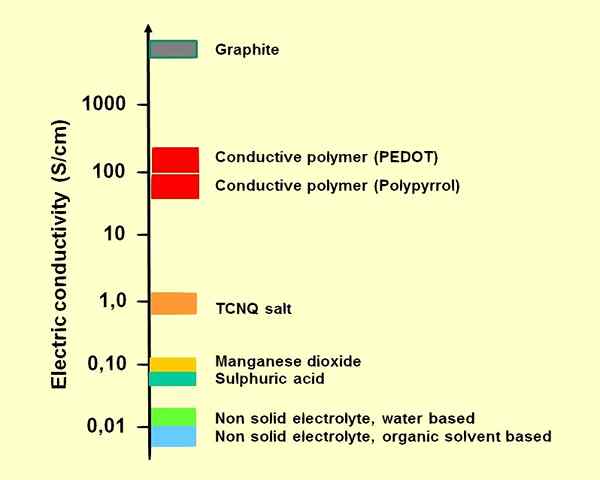
Kami dapat mengkategorikan elektrolit menjadi dua kelompok yang berbeda: elektrolit yang kuat dan elektrolit yang lemah. Di antara mereka, elektrolit yang kuat mudah menghasilkan ion saat larut. Misalnya, senyawa ionik adalah elektrolit yang kuat. Sodium klorida cair atau larutan NaCl berair mengalami disosiasi lengkap (ke dalam Na+ dan cl-ion); Oleh karena itu, mereka adalah konduktor listrik yang baik. Asam dan basa kuat juga elektrolit yang baik. Di sisi lain, elektrolit lemah menghasilkan beberapa ion saat larut dalam air. Selain itu, asam lemah seperti asam asetat dan basa lemah adalah elektrolit lemah.

Gambar 01: Konduktivitas beberapa elektrolit untuk kapasitor elektrolit
Elektrolit terjadi di tubuh juga. Kami membutuhkan elektrolit ini untuk menjaga keseimbangan ionik di dalam sel dan cairan darah dalam tubuh yang sehat. Keseimbangan elektrolit sangat penting untuk menjaga keseimbangan osmotik dan tekanan darah di dalam tubuh. Na+, K+, dan Ca2+penting dalam penularan impuls saraf dan kontraksi otot.
Apa itu elektrolisis?
Elektrolisis adalah proses menggunakan arus listrik langsung untuk menggerakkan reaksi kimia yang tidak kontan. Elektrolisis dapat dilakukan dengan menggunakan sel elektrolitik. Teknik ini sangat penting untuk memisahkan senyawa menjadi ion atau komponen lainnya.
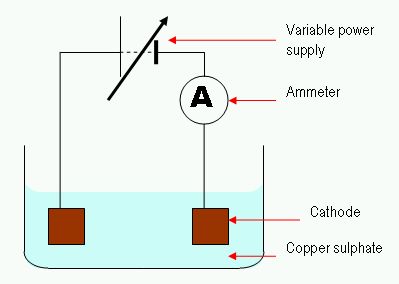
Gambar 02: Proses elektrolisis sederhana
Dalam proses elektrolisis, arus listrik melewati solusi untuk mobilitas ion dalam larutan itu. Biasanya, sel elektrolitik terdiri dari dua elektroda yang direndam dalam larutan yang sama. Kami menyebut solusi ini elektrolit. Fitur penting dalam mengatur sel elektrolitik adalah “terlalu potensial.“Kami harus memberikan tegangan yang lebih tinggi untuk melakukan reaksi non-spontan. Di sini, elektroda inert juga dapat digunakan untuk menyediakan permukaan untuk reaksi yang terjadi.
Ada banyak aplikasi elektrolisis yang berguna. Salah satu aplikasi umum adalah elektrolisis air. Di sini, air adalah elektrolit. Kemudian reaksi pemecahan molekul air menjadi gas hidrogen dan oksigen dilakukan dengan menggunakan arus listrik yang dilewatkan melalui elektrolit.
Apa perbedaan antara elektrolit dan elektrolisis?
Perbedaan utama antara elektrolit dan elektrolisis adalah bahwa elektrolit adalah zat yang dapat menghasilkan ion, sedangkan elektrolisis adalah proses di mana arus listrik digunakan untuk menggerakkan reaksi kimia. Dengan kata lain, dalam elektrolit, zat cair atau terlarut menghasilkan ion yang mampu bergerak dalam keadaan cair atau dalam larutan berair, saat dalam elektrolisis, dekomposisi elektrolit oleh arus listrik terjadi. Elektrolit dan elektrolisis saling terkait dengan satu sama lain dengan cara yang berbeda. Misalnya, elektrolisis dapat terjadi dengan adanya elektrolit.
Ringkasan -Elektrolit vs Elektrolisis
Oleh karena itu, perbedaan utama antara elektrolit dan elektrolisis adalah bahwa elektrolit adalah zat yang dapat menghasilkan ion, sedangkan elektrolisis adalah proses di mana arus listrik digunakan untuk menggerakkan reaksi kimia. Dengan kata lain, elektrolit adalah zat, sedangkan elektrolisis adalah suatu proses.
Referensi:
1. Helmenstine, Anne Marie. “Contoh Kimia: Elektrolit Kuat dan Lemah."Thoughtco, Aug. 6, 2019.
Gambar milik:
1. “Konduktivitas Elektrolit -Bantara” oleh Elcap - Pekerjaan Sendiri (CC0) via Commons Wikimedia
2. “Electrolisis Copper Sulphate” oleh Theresa Knott di Wikibooks Inggris. - Ditransfer dari en.wikibooks ke commons. (CC BY-SA 3.0) Via Commons Wikimedia


