Apa perbedaan antara persamaan keadaan dan koefisien aktivitas
Itu Perbedaan utama antara persamaan keadaan dan koefisien aktivitas adalah bahwa persamaan keadaan dapat diterapkan untuk fase cair dan gas, sedangkan koefisien aktivitas hanya diterapkan untuk gas.
Persamaan keadaan dan koefisien aktivitas adalah konsep kimia yang penting. Persamaan keadaan dapat didefinisikan sebagai persamaan termodinamika yang terkait dengan variabel keadaan yang menggambarkan keadaan materi pada kondisi fisik tertentu. Koefisien aktivitas adalah faktor yang berguna dalam termodinamika untuk akuntansi penyimpangan yang berasal dari perilaku ideal dalam campuran zat kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa persamaan negara
3. Apa itu koefisien aktivitas
4. Persamaan koefisien aktivitas status vs dalam bentuk tabel
5. Ringkasan -Persamaan koefisien aktivitas status vs
Apa persamaan negara?
Persamaan keadaan dapat didefinisikan sebagai persamaan termodinamika yang terkait dengan variabel keadaan yang menggambarkan keadaan materi pada kondisi fisik tertentu. Kondisi fisik yang dapat ditentukan termasuk tekanan, volume, suhu, dan energi internal. Persamaan ini sangat penting dalam menjelaskan sifat cairan, campuran cairan, padatan, dll.
Tidak ada persamaan negara yang menggambarkan sifat semua zat secara akurat di bawah semua kondisi. Oleh karena itu, kami menggambarkan sifat menggunakan keadaan ideal zat. Misalnya, hukum gas ideal adalah jenis persamaan negara. Persamaan ini kira -kira akurat untuk gas kutub lemah ketika tekanan rendah dan suhu sedang dipertimbangkan.
Bentuk umum persamaan negara dapat diberikan sebagai berikut:
f (p, v, t) = 0
Di sini, P adalah tekanan absolut, v adalah volume, dan t adalah suhu absolut. Hukum Gas Ideal Klasik, Hukum Gas Ideal Kuantum, Persamaan Kubik Negara, Persamaan Non-Kubik Negara, Persamaan Virial Negara, Persamaan Saft Negara, Persamaan Multiparameter Negara, dll., adalah beberapa jenis persamaan negara.
Apa itu koefisien aktivitas?
Koefisien aktivitas adalah faktor yang digunakan dalam termodinamika untuk akuntansi penyimpangan yang berasal dari perilaku ideal dalam campuran zat kimia. Saat mempertimbangkan campuran yang ideal, interaksi mikroskopis antara pasangan spesies kimia biasanya serupa. Oleh karena itu, kami dapat mengekspresikan sifat -sifat campuran secara langsung dalam hal konsentrasi sederhana atau tekanan parsial dari zat yang ada. Contohnya adalah Hukum Raoult. Kita dapat memberikan penyimpangan dari idealitas dengan memodifikasi konsentrasi menggunakan koefisien aktivitas. Kebalikan dari koefisien aktivitas adalah koefisien fugacity.

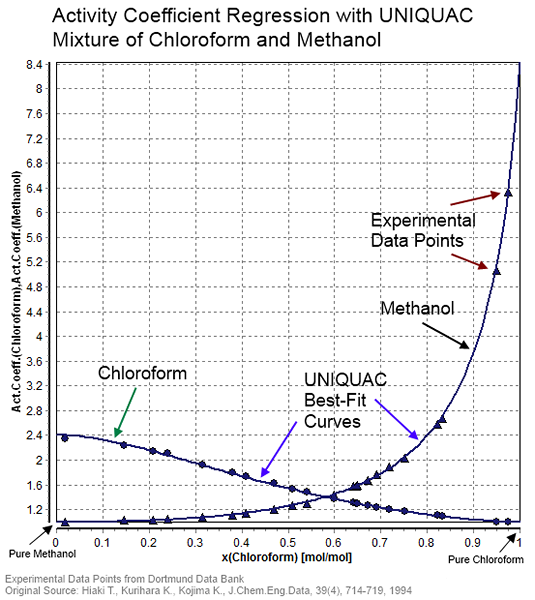
Gambar 01: Koefisien aktivitas untuk campuran kloroform dan metanol
Biasanya, kita dapat menentukan koefisien aktivitas melalui metode eksperimental. Ini dilakukan dengan melakukan pengukuran pada campuran non-ideal. Dua metode utama adalah metode radiokimia dan metode pengenceran tak terbatas. Misalnya. Kita bisa mendapatkan koefisien aktivitas untuk campuran biner pada pengenceran tak terbatas dari masing -masing komponen.
Apa perbedaan antara persamaan keadaan dan koefisien aktivitas?
Persamaan keadaan dan koefisien aktivitas adalah konsep kimia yang penting. Persamaan keadaan adalah persamaan termodinamika yang terkait dengan variabel keadaan yang menggambarkan keadaan materi pada kondisi fisik tertentu sementara koefisien aktivitas adalah faktor yang digunakan dalam termodinamika untuk akuntansi penyimpangan yang berasal dari perilaku ideal dalam campuran zat kimia. Perbedaan utama antara persamaan keadaan dan koefisien aktivitas adalah bahwa persamaan keadaan dapat diterapkan untuk fase cair dan gas, sedangkan koefisien aktivitas hanya diterapkan untuk gas. Selain itu, persamaan keadaan rumit untuk digunakan sedangkan koefisien aktivitas relatif mudah digunakan.
Infografis berikut mencantumkan perbedaan antara persamaan keadaan dan koefisien aktivitas dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Persamaan koefisien aktivitas status vs
Persamaan keadaan dan koefisien aktivitas adalah konsep kimia yang penting. Perbedaan utama antara persamaan keadaan dan koefisien aktivitas adalah bahwa persamaan keadaan dapat diterapkan untuk fase cair dan gas, sedangkan koefisien aktivitas hanya diterapkan untuk gas.
Referensi:
1. "Persamaan negara." NASA.
Gambar milik:
1. “Uniquac Regression Chloroform Methanol” oleh Wilfriedc - Karya Sendiri (CC BY -SA 3.0) Via Commons Wikimedia


