Apa perbedaan antara transisi fase urutan pertama dan kedua
Itu Perbedaan utama antara transisi fase urutan pertama dan kedua adalah bahwa transisi fase urutan pertama tergantung pada kekuatan pertama konsentrasi reaktan dalam persamaan laju, sedangkan transisi fase urutan kedua tergantung pada kekuatan kedua konsentrasi dalam persamaan laju.
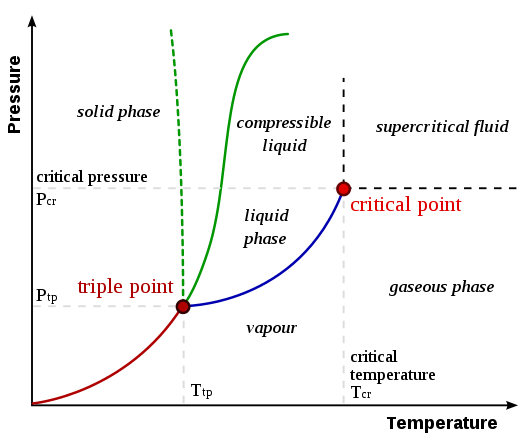
Transisi fase adalah perubahan fase materi, yang merupakan proses fisik transisi keadaan media ke keadaan yang berbeda dari media yang sama, yang diidentifikasi oleh parameter seperti kepadatan dan volume. Secara umum, istilah ini digunakan untuk menggambarkan fase seperti padatan, cair, gas, dan plasma. Jenis -jenis transisi fase termasuk peleburan, perebusan, sublimasi, penguapan, ionisasi, deposisi, kondensasi, dan rekombinasi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa transisi fase urutan pertama
3. Apa itu transisi fase urutan kedua
4. Transisi fase urutan kedua vs kedua dalam bentuk tabel
5. Ringkasan -transisi fase urutan kedua vs kedua
Apa transisi fase urutan pertama?
Transisi fase urutan pertama adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar salah satu reaktan yang terlibat dalam reaksi. Oleh karena itu, jumlah kekuatan yang diajukan konsentrasi reaktan dalam persamaan hukum tingkat akan selalu 1. Jika reaktan tunggal mengambil bagian dalam reaksi ini, konsentrasi reaktan tersebut menentukan laju reaksi. Namun terkadang, ada lebih dari satu reaktan yang mengambil bagian dalam reaksi ini. Dalam kasus seperti itu, salah satu reaktan ini akan menentukan laju reaksi.

Kita dapat mengkarakterisasi transisi fase urutan pertama dengan diskontinuitas variabel termodinamika, termasuk kepadatan dan entropi. Selain itu, jenis transisi ini biasanya ditampilkan oleh perubahan volume.
Apa itu transisi fase urutan kedua?
Transisi fase urutan kedua adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar dua reaktan atau daya kedua dari satu reaktan yang terlibat dalam reaksi. Oleh karena itu, jumlah kekuatan yang diajukan konsentrasi reaktan dalam persamaan hukum tingkat akan selalu 2. Jika ada dua reaktan, laju reaksi akan tergantung pada kekuatan pertama konsentrasi masing -masing reaktan.
Transisi fase kedua juga dikenal sebagai transisi fase kontinu karena ditandai dengan kerentanan yang berbeda, pembusukan hukum kekuatan korelasi dekat kekritisan, dll. Teori di balik transisi fase urutan kedua dikembangkan oleh para ilmuwan yang menggunakan teori Landau.
Apa perbedaan antara transisi fase urutan pertama dan kedua?
Reaksi urutan pertama dan urutan kedua dapat terjadi sebagai transisi fase. Perbedaan utama antara transisi fase urutan pertama dan kedua adalah bahwa transisi fase urutan pertama tergantung pada kekuatan pertama konsentrasi reaktan dalam persamaan laju, sedangkan transisi fase urutan kedua tergantung pada daya kedua konsentrasi dalam persamaan laju.
Di bawah ini adalah ringkasan perbedaan antara transisi fase urutan pertama dan kedua dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -transisi fase urutan kedua vs kedua
Transisi fase urutan pertama adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar salah satu reaktan yang terlibat dalam reaksi. Reaksi urutan kedua, di sisi lain, adalah reaksi kimia di mana laju reaksi tergantung pada konsentrasi molar dua reaktan atau daya kedua dari satu reaktan yang terlibat dalam reaksi. Perbedaan utama antara transisi fase urutan pertama dan kedua adalah bahwa transisi fase urutan pertama tergantung pada kekuatan pertama konsentrasi reaktan dalam persamaan laju, sedangkan transisi fase urutan kedua tergantung pada daya kedua konsentrasi dalam persamaan laju.
Referensi:
1. “Transisi Fase Pesanan." Tinjauan umum | Topik ScienceDirect.
Gambar milik:
1. "Fase-diag2" oleh Matthieumarechal (CC BY-SA 3.0) Via Commons Wikimedia


