Apa perbedaan antara spesies isotonik dan isoelektronik
Itu Perbedaan utama antara spesies isotonik dan isoelektronik adalah bahwa spesies isotonik memiliki jumlah neutron yang sama, sedangkan spesies isoelektronik memiliki jumlah elektron yang sama.
Istilah isotonik dan isoelektronik merujuk pada spesies kimia yang memiliki kesamaan, e.G., Jumlah elektron yang sama, jumlah neutron yang sama, dll.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa spesies isotonik
3. Apa itu spesies isoelektronik
4. Spesies isotonik vs isoelektronik dalam bentuk tabel
5. Ringkasan - spesies isotonik vs isoelektronik
Apa spesies isotonik?
Spesies isotonik adalah spesies kimia yang memiliki jumlah neutron yang identik. Ini juga dikenal sebagai isoton. Isoton adalah dua atau lebih nuklida dengan jumlah neutron yang sama, tetapi mereka memiliki jumlah proton yang berbeda. Nomor neutron dilambangkan dengan n, dan nomor proton dilambangkan dengan z.
Contoh umum adalah boron -12 dan karbon - 13 inti. Keduanya nuklida ini mengandung 7 neutron di setiap atom. Oleh karena itu, kita dapat menyebutkannya sebagai isoton. Kelompok yang serupa dari spesies isotonik termasuk atom dengan 20 neutron per atom. Grup ini termasuk S-36, CL-37, AR-38, K-39, dan CA-40. Semua atom ini memiliki 20 neutron tetapi jumlah proton yang berbeda. Kita bisa mendapatkan jumlah proton dengan mengurangi 20 dari angka massa. E.G., Untuk atom sulfur, jumlah proton per atom = 36 - 20 = 16.

Istilah isotonik berasal dari bahasa Yunani yang berarti “peregangan yang sama.“Itu diperkenalkan oleh fisikawan J Jerman.Guggenheimer. Mungkin ada banyak atom dengan jumlah neutron yang sama ketika mempertimbangkan isotop elemen kimia. Biasanya, jumlah terbesar nuklida yang stabil secara observasi untuk dua spesies isotonik 50 dan 82.
Apa itu spesies isoelektronik?
Spesies isoelektronik adalah spesies kimia yang memiliki jumlah elektron yang identik. Dengan kata lain, spesies isoelektronik memiliki jumlah elektron yang sama atau struktur elektronik yang sama. Fenomena ini dikenal sebagai isoelektronik.
Misalnya, karbon monoksida, NO+, dan N2 adalah spesies kimia isoelektronik karena struktur ini memiliki jumlah elektron yang sama per senyawa. Sebaliknya, CH3COOH dan CH3N = NCH3 bukan isoelektronik karena mereka memiliki jumlah elektron yang berbeda.

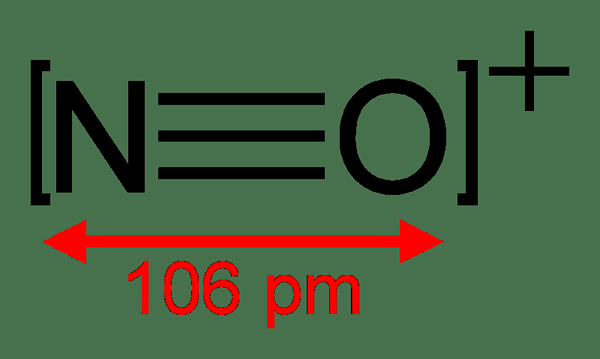
Pentingnya mengidentifikasi spesies kimia isoelektronik adalah kemampuan untuk mempelajari spesies yang secara signifikan terkait sebagai pasangan atau seri. Selain itu, kita dapat mengharapkan ini berguna dalam konsistensi dan prediktabilitas sifat -sifat spesies kimia ini. Oleh karena itu, ini memberi kita petunjuk tentang sifat dan reaksi yang mungkin terjadi.
Misalnya, n atom dan ion O+ adalah isoelektronik satu sama lain. Ini karena kedua spesies ini memiliki lima elektron valensi dan [He] 2S22P3. Contoh umum lainnya adalah serangkaian kation dengan K+, Ca2+, dan SC3+. Demikian pula, Cl-, S2-, dan P3- adalah seri anion dengan jumlah elektron yang sama.
Dalam molekul diatomik, kita dapat menggunakan diagram orbital molekul untuk menggambarkan isoelektronik dalam molekul diatomik. Ini menunjukkan orbital atom yang bercampur dalam spesies isoelektronik, menunjukkan kombinasi orbital yang identik serta ikatan.
Ada beberapa senyawa polyatomic yang bisa menjadi isoelektronik satu sama lain. Contoh yang umum diketahui adalah seri asam amino dengan serin, sistein, dan selenocysteine. Asam amino ini berbeda satu sama lain sesuai dengan chalcogen spesifik yang ada di lokasi di rantai samping.
Apa perbedaan antara spesies isotonik dan isoelektronik?
Spesies kimia isotonik dan isoelektronik penting dalam mempelajari sifat kimia senyawa terkait. Perbedaan utama antara spesies isotonik dan isoelektronik adalah bahwa pada spesies isotonik, jumlah neutron adalah sama, sedangkan, pada spesies isoelektronik, jumlah elektronnya sama.
Infografis di bawah ini menyajikan perbedaan antara spesies isotonik dan isoelektronik dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -spesies isotonik vs isoelektronik
Spesies isotonik adalah spesies kimia yang memiliki jumlah neutron yang identik. Spesies isoelektronik adalah spesies kimia yang memiliki jumlah elektron yang identik. Oleh karena itu, perbedaan utama antara spesies isotonik dan isoelektronik adalah bahwa spesies isotonik memiliki jumlah neutron yang sama, sedangkan spesies isoelektronik memiliki jumlah elektron yang sama.
Referensi:
1. “Manakah dari spesies berikut yang isotonik dengan 37 RB 86 ?" Tardigrade, 30 Oktober. 2019.
Gambar milik:
1. "Isotop dan Half -Life" oleh Benrg - karya sendiri (domain publik) melalui Commons Wikimedia
2. "Carbon Monoxide Simple" oleh Yikrazuul (Talk) - Pekerjaan Sendiri (Domain Publik) Via Commons Wikimedia
3. “Nitrosonium-2D-dimensi” (domain publik) melalui Commons Wikimedia