Perbedaan antara garam asam dan garam basa

Itu perbedaan utama Antara garam asam dan garam basa Garam asam membentuk larutan yang kurang dari pH 7.0 Saat dilarutkan dalam air, sedangkan garam dasar membentuk larutan yang lebih tinggi dari pH 7.0 Saat dibubarkan dalam air.
Garam adalah senyawa ionik yang mengandung kation dan anion. Ini adalah senyawa padat yang tidak memiliki muatan bersih karena kation dan anion bergabung satu sama lain sedemikian rupa sehingga muatan listrik kation seimbang dengan anion. Tergantung pada komposisi ionik garam, sifat dan reaktivitas dapat ditentukan. Oleh karena itu, kami dapat mengkategorikan garam menjadi tiga kelompok sebagai garam asam, garam basa dan garam netral.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu garam asam
3. Apa itu garam dasar
4. Perbandingan berdampingan - garam asam vs garam dasar dalam bentuk tabel
5. Ringkasan
Apa itu garam asam?
Garam asam adalah senyawa ionik yang dapat membentuk larutan asam setelah pembubaran dalam air. Itu berarti; Garam asam membentuk larutan berair yang kurang dari pH 7.0. Ini terjadi baik karena adanya kation logam yang dapat bereaksi sebagai asam Lewis atau karena adanya proton yang dapat dihidrolisis. Paling umum, garam asam mengandung proton yang dapat dihidrolisis. Proton yang dapat dihidrolisis ini mungkin ada di kation atau anion.
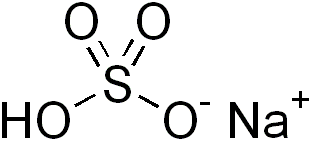
Gambar 01: Sodium bisulfit adalah garam asam
Proton terhidrolisis di kation
Garam asam yang mengandung kation dengan proton yang dapat dihidrolisis terutama ion amonium. Ion amonium berasal dari garam amonium. Selain itu, proton yang dapat dihidrolisis ini dapat terjadi pada senyawa organik yang mengandung gugus amina terprotonasi. E.G. ion amonium, ion metil amonium, ion etil amonium, ion anilinium, dll.
Proton terhidrolisis dalam anion
Garam asam dapat mengandung proton yang dapat dihidrolisis di anion. Contohnya termasuk ion bisulfit, dihidrogen sitrat, ion bioksalat, dll. Anion ini mengandung proton yang dipisahkan dengan lemah menjadi air.
Apa itu garam dasar?
Garam dasar adalah senyawa ionik yang dapat membentuk solusi dasar setelah pembubaran dalam air. Itu berarti; Garam ini dapat membentuk larutan berair yang memiliki pH lebih tinggi dari 7.0. Secara umum, garam dasar dapat mendeprotonasi molekul air dan membentuk ion hidroksida yang dapat menyebabkan kebasaan dalam larutan berair.

Gambar 02: Sodium sulfida adalah garam dasar
Beberapa contoh garam dasar termasuk natrium bikarbonat, kalsium karbonat, natrium asetat, kalium sianida, dan natrium sulfida. Garam ini dapat bereaksi dengan air, memaksa molekul air untuk menghilangkan ion hidroksida.
Apa perbedaan antara garam asam dan garam basa?
Perbedaan utama antara garam asam dan garam basa adalah bahwa garam asam membentuk larutan yang kurang dari pH 7.0 Saat dilarutkan dalam air, sedangkan garam dasar membentuk larutan yang lebih tinggi dari pH 7.0 Saat dibubarkan dalam air. Garam amonium, natrium bisulfit, dan kalsium oksalat adalah beberapa contoh garam asam, sedangkan natrium bikarbonat, kalsium karbonat, natrium asetat, kalium sianida, dan natrium sulfida adalah beberapa contoh garam dasar.
Di bawah infografis merangkum perbedaan antara garam asam dan garam basa.
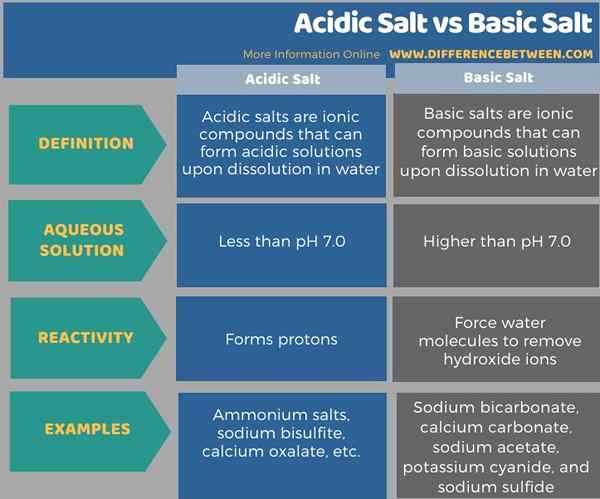
Ringkasan -garam asam vs garam basa
Tergantung pada komposisi ionik garam, sifat dan reaktivitas dapat ditentukan. Oleh karena itu, kami dapat mengkategorikan garam menjadi tiga kelompok sebagai garam asam, garam basa dan garam netral. Perbedaan utama antara garam asam dan garam basa adalah bahwa garam asam membentuk larutan yang kurang dari pH 7.0 Saat dilarutkan dalam air, sedangkan garam dasar membentuk larutan yang lebih tinggi dari pH 7.0 Saat dibubarkan dalam air.
Referensi:
1. “Sifat asam-basa garam.Lumen "kimia tak terbatas", tersedia di sini.
2. “7.8: Sifat asam-basa garam.”Kimia Libretexts, Libretexts, 3 Juni 2019, tersedia di sini.
3. “Garam asam."Wikipedia, Wikimedia Foundation, 17 Okt. 2019, tersedia di sini.
Gambar milik:
1. "Sodium Bisulfate" oleh Edgar181 - karya sendiri, domain publik) via Commons Wikimedia
2. “Sodium Sulfide Nonahydrate Crystals” oleh Leiem - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


