Perbedaan antara adiabatik dan isotermal
Itu perbedaan utama antara adiabatik dan isotermal adalah itu adiabatik berarti tidak ada pertukaran panas antara sistem dan sekitarnya sementara isotermal berarti tidak ada perubahan suhu.
Untuk tujuan kimia, alam semesta dibagi menjadi dua bagian. Bagian yang kami minati disebut sistem, dan sisanya disebut di sekitarnya. Suatu sistem dapat berupa organisme, kapal reaksi atau bahkan sel tunggal. Sistem dibedakan dengan jenis interaksi yang mereka miliki atau oleh jenis pertukaran yang terjadi.
Sistem dapat diklasifikasikan menjadi dua sebagai sistem terbuka dan sistem tertutup. Terkadang, masalah dan energi dapat dipertukarkan melalui batas -batas sistem. Energi yang dipertukarkan dapat mengambil beberapa bentuk seperti energi cahaya, energi panas, energi suara, dll. Jika energi suatu sistem berubah karena perbedaan suhu, kami katakan telah ada aliran panas. Adiabatik dan polytropic adalah dua proses termodinamika, yang terkait dengan perpindahan panas dalam sistem.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa adiabatik
3. Apa itu isotermal
4. Perbandingan berdampingan - adiabatik vs isotermal dalam bentuk tabel
5. Ringkasan
Apa adiabatik?
Perubahan adiabatik adalah perubahan di mana tidak ada panas yang ditransfer ke dalam atau keluar dari sistem. Perpindahan panas sebagian besar dapat dihentikan dalam dua cara. Salah satunya adalah dengan menggunakan batas terisolasi termal sehingga tidak ada panas yang dapat masuk atau keluar. Misalnya, reaksi yang dilakukan dalam labu embun adalah adiabatik. Jenis proses adiabatik lainnya terjadi ketika suatu proses berlangsung dengan sangat cepat; Dengan demikian, tidak ada waktu tersisa untuk mentransfer panas masuk dan keluar.
Dalam termodinamika, perubahan adiabatik ditunjukkan oleh dq = 0. Dalam hal ini, ada hubungan antara tekanan dan suhu. Oleh karena itu, sistem mengalami perubahan karena tekanan dalam kondisi adiabatik. Inilah yang terjadi dalam pembentukan awan dan arus konveksi skala besar. Pada ketinggian yang lebih tinggi, ada tekanan atmosfer yang lebih rendah. Saat udara dipanaskan, cenderung naik. Karena tekanan udara luar rendah, parsel udara yang naik akan mencoba berkembang. Saat mengembang, molekul udara bekerja, dan ini akan mempengaruhi suhu mereka. Itulah sebabnya suhu berkurang saat naik.
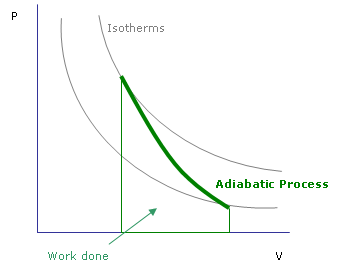
Gambar 01: Proses adiabatik
Menurut termodinamika, energi dalam parsel tetap konstan, tetapi dapat dikonversi untuk melakukan pekerjaan ekspansi atau mungkin untuk mempertahankan suhunya. Tidak ada pertukaran panas dengan bagian luar. Fenomena yang sama ini juga dapat diterapkan pada kompresi udara (e.G.: piston). Dalam situasi itu, ketika parsel udara mengompres suhu meningkat. Proses ini disebut pemanasan dan pendinginan adiabatik.
Apa itu isotermal
Perubahan isotermal adalah sistem di mana sistem tetap pada suhu konstan. Oleh karena itu, dt = 0. Suatu proses bisa isotermal, jika itu terjadi dengan sangat lambat dan jika prosesnya dapat dibalikkan. Sehingga, perubahan terjadi sangat lambat, ada cukup waktu untuk menyesuaikan variasi suhu. Selain itu, jika suatu sistem dapat bertindak seperti heat sink, di mana ia dapat mempertahankan suhu yang konstan setelah menyerap panas, itu adalah sistem isotermal.

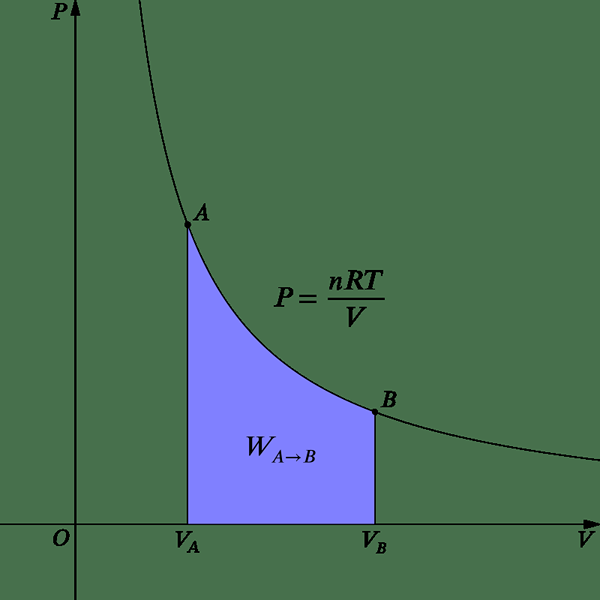
Gambar 2: Perubahan isotermal
Untuk cita -cita dalam kondisi isotermal, tekanan dapat diberikan dari persamaan berikut.
P = NRT /V
Sejak bekerja, W = pdv Persamaan berikut dapat diturunkan.
W = nrt ln (vf/vi)
Oleh karena itu, pada suhu konstan ekspansi atau pekerjaan kompresi terjadi saat mengubah volume sistem. Karena tidak ada perubahan energi internal dalam proses isotermal (DU = 0), semua panas yang disediakan digunakan untuk melakukan pekerjaan. Inilah yang terjadi di mesin panas.
Apa perbedaan antara adiabatik dan isotermal?
Adiabatik berarti tidak ada pertukaran panas antara sistem dan sekitarnya, oleh karena itu, suhu akan meningkat jika kompresi, atau suhu akan berkurang dalam ekspansi. Sebaliknya, cara isotermal, tidak ada perubahan suhu; Dengan demikian, suhu dalam suatu sistem konstan. Ini diperoleh dengan mengubah panas. Dalam adiabatik dq = 0, tetapi dt ≠ 0. Namun, dalam perubahan isotermal dt = 0 dan dq ≠ 0. Jadi, ini adalah perbedaan utama antara adiabatik dan isotermal. Selain itu, perubahan adiabatik terjadi dengan cepat, sedangkan perubahan isotermal terjadi dengan sangat lambat.
Di bawah Info-Grafik merangkum perbedaan antara adiabatik dan isotermal.
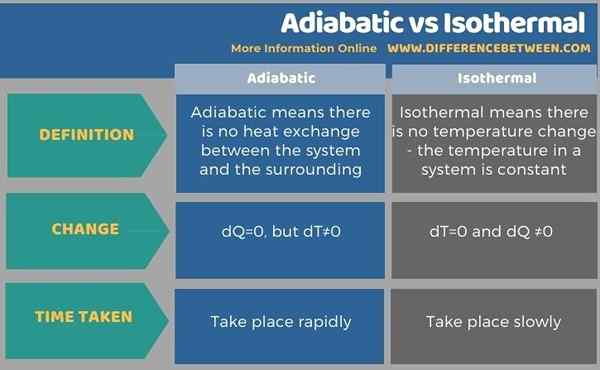
Ringkasan -adiabatik vs isotermal
Perbedaan utama antara adiabatik dan isotermal adalah bahwa adiabatik berarti tidak ada pertukaran panas antara sistem dan sekitarnya sementara isotermal berarti tidak ada perubahan suhu.
Gambar milik:
1. "Adiabatic" (CC BY-SA 3.0) Via Commons Wikimedia
2. “Proses Isotermal” oleh Netheril96 - Pekerjaan Sendiri (CC0) via Commons Wikimedia


