Perbedaan antara alpha helix dan beta lipit
Perbedaan Utama - Lembar Lipit Alpha Helix vs Beta
Heliks alfa dan lembaran lipit beta adalah dua struktur sekunder yang paling umum ditemukan dalam rantai polipeptida. Dua komponen struktural ini adalah langkah utama pertama dalam proses melipat rantai polipeptida. Itu perbedaan utama Antara alpha helix dan beta lipit di dalamnya struktur; Mereka memiliki dua bentuk berbeda untuk melakukan pekerjaan tertentu.
Apa itu alpha helix?
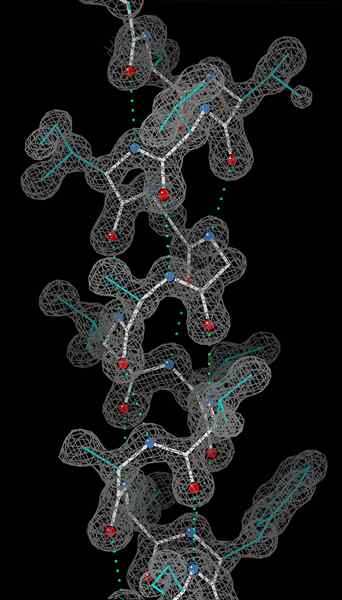
Helix alpha adalah kumparan residu asam amino tangan kanan pada rantai polipeptida. Kisaran residu asam amino dapat bervariasi dari 4 hingga 40 residu. Ikatan hidrogen yang terbentuk antara oksigen gugus C = O pada kumparan atas dan hidrogen kelompok N-H dari koil bawah membantu menahan koil bersama-sama. Ikatan hidrogen terbentuk per setiap empat residu asam amino dalam rantai dengan cara di atas. Pola seragam ini memberikan fitur yang pasti seperti ketebalan koil dan menentukan panjang setiap belokan lengkap di sepanjang sumbu helix. Stabilitas struktur helix alpha tergantung pada beberapa faktor.

O Atom berwarna merah, n atom berwarna biru, dan ikatan hidrogen sebagai garis putus -putus hijau
Apa itu lembaran lipit beta?
Lembar lipit beta, juga dikenal sebagai lembaran beta, dianggap sebagai bentuk kedua dari struktur sekunder dalam protein. Ini berisi untaian beta yang terhubung secara lateral dengan minimal dua atau tiga ikatan hidrogen tulang punggung untuk membentuk lembaran yang dipelintir dan lipit seperti yang ditunjukkan pada gambar. Untai beta adalah hamparan rantai polipeptida; Panjangnya umumnya sama dengan 3 hingga 10 asam amino, termasuk tulang punggung dalam konfirmasi yang diperpanjang.
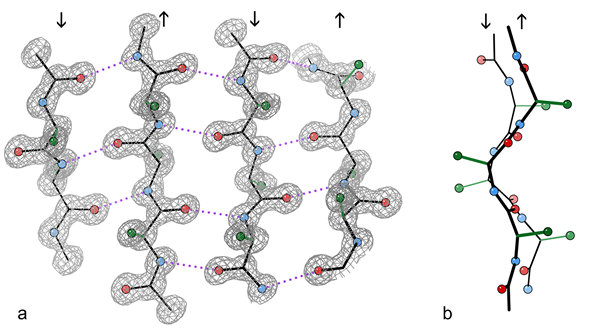
Fragmen lembaran β antiparalel 4-untai dari struktur kristal enzim katalase.
A) Menunjukkan ikatan hidrogen antiparalel (putus -putus) antara kelompok peptida NH dan CO pada untaian yang berdekatan. Panah menunjukkan arah rantai, dan kontur kerapatan elektron menguraikan atom non-H. O Atom adalah bola merah, atom n berwarna biru, dan atom H dihilangkan untuk kesederhanaan; Sidechains hanya ditampilkan ke atom C Sidechain pertama (hijau)
b) Tampilan tepi dari dua untai β sentral
Dalam lembaran lipit beta, rantai polipeptida saling bersamaan. Itu mendapatkan nama "lembaran lipit" karena penampilan seperti gelombang dari struktur. Mereka dihubungkan bersama oleh ikatan hidrogen. Struktur ini memungkinkan pembentukan lebih banyak ikatan hidrogen dengan merentangkan rantai polipeptida.
Apa perbedaan antara alpha helix dan sheet lipit beta?
Struktur alpha helix dan beta lipit
Alpha Helix:
Dalam struktur ini, tulang punggung polipeptida terikat erat di sekitar sumbu imajiner sebagai struktur spiral. Ini juga dikenal sebagai susunan helikoid rantai peptida.
Pembentukan struktur helix alpha terjadi ketika rantai polipeptida dipelintir menjadi spiral. Ini memungkinkan semua asam amino dalam rantai untuk membentuk ikatan hidrogen (ikatan antara molekul oksigen dan molekul hidrogen) satu sama lain. Ikatan hidrogen memungkinkan helix menahan bentuk spiral dan memberikan koil yang kencang. Bentuk spiral ini membuat alfa helix sangat kuat.
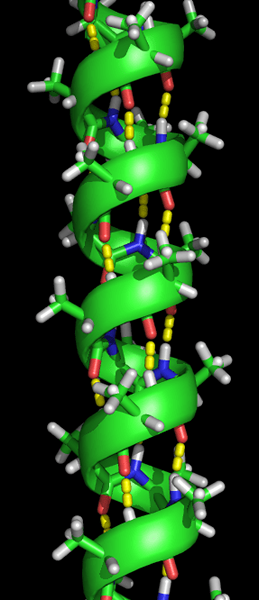
Ikatan hidrogen ditunjukkan oleh titik -titik kuning.
Lembar lipit beta:
Ketika dua atau lebih fragmen rantai polipeptida tumpang tindih satu sama lain, membentuk deretan ikatan hidrogen satu sama lain, mengikuti struktur dapat ditemukan. Itu bisa terjadi dalam dua cara; Pengaturan paralel dan pengaturan anti-paralel.
Contoh struktur:
Alpha Helix: Kuku atau kuku dapat diambil sebagai contoh struktur helix alfa.
Lembar lipit beta: Struktur bulu mirip dengan struktur lembaran lipit beta.
Fitur struktur:
Alpha Helix: Dalam struktur alpha helix, ada 3.6 asam amino per belokan heliks. Semua ikatan peptida adalah trans dan planar, dan kelompok N-H dalam ikatan peptida titik dalam arah yang sama, yang kira-kira sejajar dengan sumbu heliks. Kelompok C = O dari semua ikatan peptida menunjuk ke arah yang berlawanan, dan mereka sejajar dengan sumbu heliks. Kelompok C = O dari setiap ikatan peptida terikat pada kelompok N-H dari ikatan peptida yang membentuk ikatan hidrogen. Semua grup r diarahkan ke luar dari heliks.
Lembar lipit beta: Setiap ikatan peptida dalam lembar lipit beta adalah planar dan memiliki transformasi trans. Kelompok C = O dan N-H ikatan peptida dari rantai yang berdekatan berada di bidang yang sama dan menunjuk satu sama lain membentuk ikatan hidrogen di antara mereka. Semua kelompok R dalam rantai apa pun dapat terjadi di atas dan di bawah bidang lembaran.
Definisi:
Struktur Sekunder: Ini adalah bentuk protein lipat karena ikatan hidrogen antara gugus amida dan karbonil tulang punggungnya.
Referensi: "Struktur Protein". Chemwiki: Hypertext Kimia Dinamis “Struktur Sekunder Protein: Heliks α dan β-sheet” . Struktur Protein.com oleh Salam al Karadaghi "Kimia Organik". Buku teks sel virtual "Lembar Beta".Wikipedia Gambar milik: “Helix Electron Density Myoglobin 2nrl 17-32” oleh DCRJSR - Karya Sendiri (CC oleh 3.0) Via Commons Wikimedia “Struktur Sekunder Protein” oleh EN: Pengguna: Bikadi (CC BY-SA 3.0) Via Commons Wikimedia "1GWE Antipar Beta Sheet Keduanya" oleh DCRJSR - Pekerjaan Sendiri (CC oleh 3.0) Via Commons Wikimedia

