Perbedaan antara argon dan oksigen
Perbedaan Utama - Argon VS. Oksigen
Argon dan oksigen adalah dua elemen kimia dalam tabel periodik. Keduanya adalah elemen gas, di mana argon berada dalam keluarga gas mulia dan oksigen berasal dari kelompok chalcogen dalam tabel periodik. Argon adalah gas inert sedangkan oksigen adalah gas yang sangat reaktif. Oksigen adalah salah satu elemen paling berlimpah di planet ini sementara Argon adalah salah satu gas mulia yang paling berlimpah. Argon diproduksi saat oksigen kemurnian tinggi diproduksi. Mereka memiliki titik didih yang relatif dekat, tetapi sifat kimianya sangat berbeda satu sama lain. Karena Anda dapat mengamati perbedaan antara argon dan oksigen banyak. Artikel ini berupaya memberi Anda pemahaman yang diklarifikasi tentang perbedaan.
Apa itu argon?
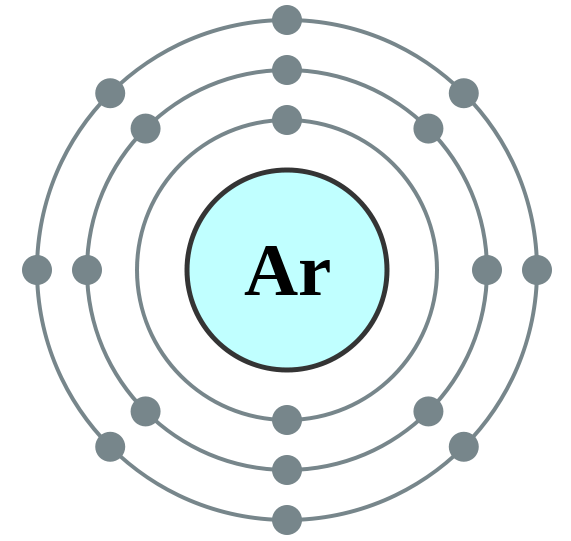
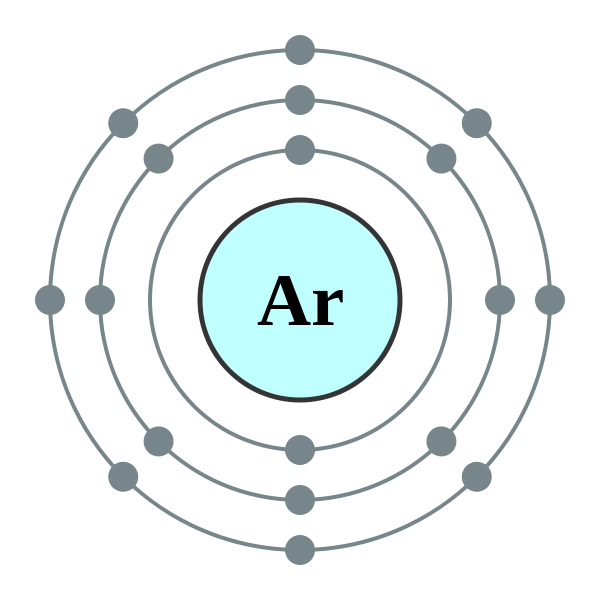
Argon (ar) adalah anggota keluarga khusus; Mereka disebut gas "langka", "mulia" atau "inert". Semua gas dalam keluarga ini memiliki cangkang terluar yang benar -benar terisi dan reaktivitas kimianya hampir nol. Argon adalah gas monatomik, tidak berwarna, tidak berbau, tidak berasa dan tidak beracun. Argon sedikit larut dalam air. Kelimpahannya di atmosfer hampir 0.934% berdasarkan volume. Argon dianggap sebagai gas inert paling berlimpah. Semua anggota keluarga Gas Noble memancarkan cahaya ketika mereka bersemangat secara elektrik; Dalam hal ini Argon menghasilkan cahaya violet biru pucat.
Apa itu oksigen?
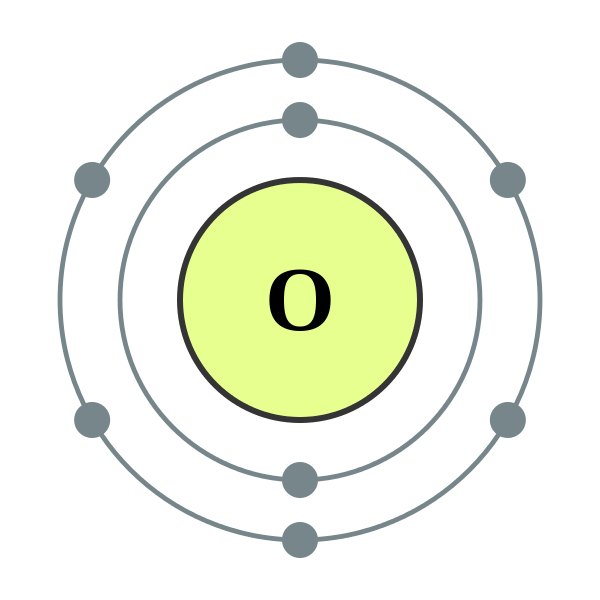
Oksigen dapat dianggap sebagai Salah satu elemen paling berlimpah di bumi. Sekitar 21% oksigen unsur bebas hadir di atmosfer kita. Selain itu, dikombinasikan dengan senyawa lain seperti air dan mineral. Bahkan fungsi tubuh manusia kita menggunakan oksigen dan mengandung 65% oksigen berdasarkan massa. Oksigen secara alami terjadi sebagai molekul gas diatomik, o2 (G). Ini adalah gas yang tidak berwarna, hambar dan tidak berbau dengan sifat kimia dan fisiknya yang unik. Kepadatan oksigen lebih besar dari udara dan memiliki kelarutan yang sangat rendah dalam air.
Reaktivitas kimia oksigen sangat tinggi; itu bereaksi dengan hampir semua elemen dalam kondisi yang berbeda, kecuali gas mulia dan beberapa logam yang kurang reaktif. Oksigen adalah elemen paling reaktif di sebelah fluor (f).
Apa perbedaan antara argon dan oksigen?
Properti:
| Properti | Argon | Oksigen |
| Nomor atom | 18 | 8 |
| Konfigurasi elektronik | 1S² 2S² 2P63S² 3P⁶ | 1S² 2S² 2P⁴ |
| Titik didih | -185.9 ° C (-302.6 ° F) | -182 ° C (-297 ° F) |
| Titik lebur | -189 ° C (-308 ° F) | -218 ° C (-361 ° F) |
Berat:
Argon: Argon adalah 1.4 kali lebih berat dari udara; itu tidak bernafas sebagai oksigen dan dapat menyebabkan mencekik dengan mengatur di bagian bawah di paru -paru.
Oksigen: Oksigen juga lebih padat dari udara, tetapi gasnya ringan yang bernapas.
Penggunaan:
Argon: Argon adalah gas inert bahkan pada suhu tinggi, dan untuk alasan ini, digunakan dalam beberapa proses industri kritis seperti dalam pembuatan baja tahan karat berkualitas tinggi dan dalam memproduksi kristal silikon bebas pengotor untuk semikonduktor. Ini banyak digunakan sebagai gas pengisi inert di bola lampu. Tetap tidak reaktif bahkan ketika bohlam dipanaskan hingga suhu tinggi.
Oksigen: Oksigen banyak digunakan dalam industri logam dengan asetilena dan gas bahan bakar lainnya untuk pemotongan logam, pengelasan, peleburan, pengerasan, syal, dan pembersihan. Oksigen gas atau udara yang diperkaya oksigen digunakan dalam pembuatan baja dan besi, dalam proses pemurnian dan pemanasan kimia untuk menghilangkan karbon, dan dalam reaksi oksidasi.
Industri minyak bumi juga secara luas menggunakan oksigen sebagai pakan untuk bereaksi dengan hidrokarbon untuk menghasilkan bahan kimia seperti aldehida dan alkohol.
Gambar milik:
1. Electron Shell 018 Argon - No Label oleh Commons: Pengguna: Pumbaa (Pekerjaan Asli oleh Commons: Pengguna: Greg Robson) [CC BY -SA 2.0], via Wikimedia Commons
2. Electron Shell 008 Oksigen (diatomik nonmetal) - tidak ada label oleh depiep (karya sendiri) [CC BY -SA 3.0], via Wikimedia Commons


