Perbedaan antara ekonomi atom dan persentase hasil
Perbedaan Utama - Hasil Ekonomi Atom vs Persentase
Ekonomi atom dan hasil persentase digunakan untuk menentukan efisiensi sintesis kimia. Penentuan ekonomi atom sangat penting karena memberikan rincian tentang seberapa hijau prosesnya. Itu juga menunjukkan pemborosan atom selama proses. Hasil persentase adalah jumlah produk yang diberikan oleh reaksi kimia sehubungan dengan jumlah yang diharapkan yang diharapkan (jumlah teoretis). Perbedaan utama antara ekonomi atom dan persentase hasil adalah itu Ekonomi atom dihitung dengan membagi massa molar dari produk yang diinginkan dengan massa molar dari semua reaktan sedangkan persentase hasil dihitung dengan menyelam hasil aktual produk dari hasil teoritis produk tersebut.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Ekonomi Atom
3. Berapa persentase hasil
4. Kesamaan antara ekonomi atom dan persentase hasil
5. Perbandingan Berdampingan - Ekonomi Atom vs Hasil Persentase Dalam Bentuk Tabel
6. Ringkasan
Apa itu Ekonomi Atom?
Ekonomi atom atau efisiensi atom adalah penentuan efisiensi sintesis kimia sehubungan dengan atom yang digunakan selama reaksi sintesis. Jika ekonomi atom 100%, itu berarti semua atom yang terlibat dalam proses telah digunakan selama proses. Ini berarti semua atom dalam reaktan telah dikonversi menjadi atom produk. Jika ekonomi atom suatu proses tinggi, itu disebut a proses hijau.
Persamaan untuk Perhitungan Ekonomi Atom
Penentuan ekonomi atom dapat dilakukan melalui persamaan berikut.
Ekonomi Atom = (massa molar dari produk/massa molar yang diinginkan dari semua reaktan) x 100%

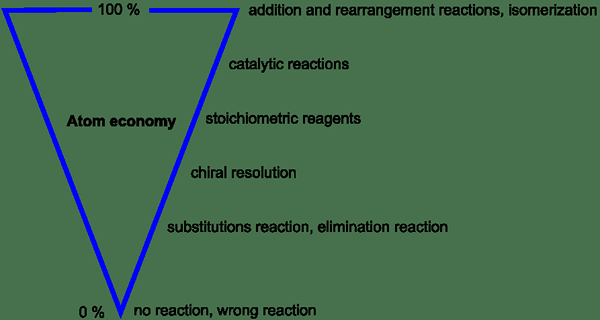
Gambar 1: Variasi ekonomi atom berdasarkan parameter yang berbeda
Dalam proses yang ideal, semua atom dalam reaktan digunakan oleh proses dan dikonversi menjadi reaktan. Oleh karena itu, tidak ada atom yang terbuang. Tetapi dalam proses aktual, ekonomi atom lebih rendah dari 100%. Ini karena produksi produk sampingan alih -alih hanya memberikan produk yang diinginkan. Ini adalah perhatian utama dalam hal proses yang mengkonsumsi bahan baku berbiaya tinggi.
Contoh
Produksi anhidrida maleik dari benzena. Ini adalah reaksi oksidasi; Reaktan yang terlibat dalam prosesnya adalah benzena dan oksigen molekuler.
Benzene + 4.5oxygen → maleic anhydride + 2carbon dioksida + 2water
Massa molar produk yang diinginkan = (12 × 4) + (16 × 3) + (1 × 2)
= 98 g/mol
Massa molar dari semua reaktan; benzena = (12 × 6) + (1 × 6)
= 78 g/mol
Oksigen molekuler = 4.5 (16 × 2)
= 144 g/mol
Total massa reaktan = 78 + 144
= 222 g/mol
Ekonomi Atom = (98/222) x 100%
= 44.14%
Berapa persentase hasil?
Persentase hasil (juga disebut persen hasil) adalah hasil aktual yang diperoleh dari reaksi sintesis kimia, sehubungan dengan hasil teoritis. Nilainya diberikan sebagai persentase. Hasil aktual adalah apa yang kita peroleh dari percobaan sedangkan hasil teoritis adalah nilai yang dihitung dari persamaan reaksi kimia, mengingat stoikiometri.
Saat menghitung hasil teoretis, seseorang harus mempertimbangkan reagen yang membatasi. Membatasi reagen atau membatasi reaktan adalah reaktan yang menentukan berapa banyak produk yang telah dibuat. Reaktan pembatas dikonsumsi selama reaksi di mana reaktan lain tetap bahkan setelah selesainya reaksi karena mereka adalah reagen berlebih.
Bagaimana menemukan reagen yang membatasi?
Mis: Mari kita pertimbangkan reaksi antara Al (14 g) dan CL2 (4.25 g) Gas. Produk akhir adalah ALCL3.
2al+ 3Cl2 → 2alcl3
Tol Mol dari AL hadir = 14/26.98 = 0.52 mol
Mol dari CL2 Hadir = 4.25/70.90 = 0.06 mol
Rasio stoikiometrik antara AL dan CL2 = 2: 3
Oleh karena itu, 2 mol AL bereaksi dengan 3 mol dari CL2. Kemudian jumlah CL2 diperlukan untuk bereaksi dengan 0.52 mol al adalah = (3/2) x 0.52 = 0.78 mol
Tapi, hanya 0.06 mol hadir. Oleh karena itu, Cl2 adalah reagen yang membatasi di sini. Kemudian hasil teoritis dihitung menggunakan jumlah AL yang ada dalam campuran reaksi.
Yield Teoritis = (2/3) x 0.06 x 133.3 = 5.33 g
Jika hasil aktual yang diperoleh dari percobaan diberikan sebagai 4.33g, maka persentase hasil dapat dihitung sebagai berikut.
Persentase hasil = (4.33 /5.33) x 100% = 81.24%
Apa kesamaan antara ekonomi atom dan persentase hasil?
- Ekonomi atom dan persentase hasil adalah persentase.
- Ekonomi atom dan persentase hasil sangat berguna untuk menentukan efisiensi proses kimia.
Apa perbedaan antara ekonomi atom dan persentase hasil?
Ekonomi Atom vs Hasil Persentase | |
| Ekonomi atom adalah penentuan efisiensi sintesis kimia sehubungan dengan atom yang digunakan selama reaksi sintesis. | Hasil persentase adalah hasil aktual yang diperoleh dari reaksi sintesis kimia, sehubungan dengan hasil teoritis. |
| Tujuan | |
| Ekonomi atom dihitung untuk memperkirakan efisiensi suatu proses dan untuk menentukan limbah atom. | Hasil persentase dihitung untuk menentukan jumlah produk yang diberikan secara praktis jika dibandingkan dengan harapan teoritis. |
| Perhitungan | |
| Ekonomi atom dihitung dengan membagi massa molar dari produk yang diinginkan dengan massa molar dari semua reaktan | Hasil persentase dihitung dengan menyelam hasil aktual produk dari hasil teoritis produk. |
Ringkasan -Hasil Ekonomi Atom vs Persentase
Ekonomi atom dan hasil persentase adalah nilai persentase yang dihitung mengenai reaksi kimia. Perbedaan utama antara ekonomi atom dan persentase hasil adalah bahwa ekonomi atom dihitung dengan membagi massa molar dari produk yang diinginkan dengan massa molar dari semua reaktan sedangkan hasil persentase dihitung dengan menyelam hasil aktual produk dari hasil teoritis dari produk.
Referensi:
1. “Membatasi reagen dan persen hasil.Khan Academy, tersedia di sini.
2. “Ekonomi Atom.”Wikipedia, Wikimedia Foundation, 28 Feb. 2018, tersedia di sini.
Gambar milik:
1.”Atom Economy V3 En” oleh Astrid 91 - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


