Perbedaan antara unit massa atom dan massa atom
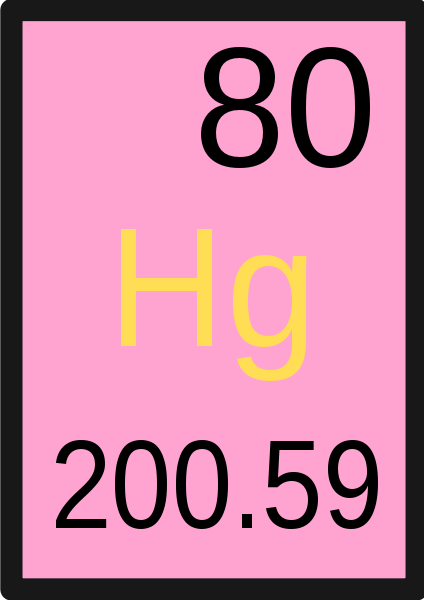
Itu perbedaan utama antara unit massa atom dan massa atom adalah bahwa Unit massa atom adalah unit yang kami gunakan untuk mengukur massa atom sedangkan massa atom adalah massa atom tunggal tertentu.
Mengekspresikan bobot atom atau molekul adalah masalah bagi para ilmuwan pada tahap awal. Karena atom sangat kecil, kami tidak dapat mengukur massa mereka menggunakan unit reguler seperti kilogram atau gram atau bahkan dalam mikrogram. Oleh karena itu, para ilmuwan datang dengan konsep baru untuk mengukur ini.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu unit massa atom
3. Apa itu massa atom
4. Perbandingan Berdampingan - Unit Massa Atom vs Massa Atom dalam Bentuk Tabel
5. Ringkasan
Apa itu unit massa atom?
Massa atom sangat kecil. Dengan demikian, kami tidak dapat mengekspresikannya dalam unit massa normal seperti gram atau kilogram. Oleh karena itu, kita perlu menggunakan unit lain yang disebut unit massa atom (AMU) untuk mengukur massa atom. Satu unit massa atom adalah seperempat dari massa isotop C-12, yaitu 1.66 x 10−27 kg. Ketika kita membagi massa atom dengan seperempat dari massa isotop C-12, kita bisa mendapatkan massa relatifnya. Dan, nilai ini adalah jumlah kecil, yang mudah digunakan dalam perhitungan dan untuk tujuan lain. Namun, secara umum digunakan, ketika kita mengatakan massa atom relatif dari suatu unsur, yang kita maksudkan adalah berat atom mereka (karena kita menghitungnya dengan mempertimbangkan semua isotop).
Sebelum menggunakan karbon-12 sebagai standar untuk mengukur unit massa atom, orang menggunakan elemen lain. Misalnya, H-1 digunakan terlebih dahulu. Kemudian, mereka mengubah ini untuk mengurangi kesalahan. Setelah itu, mereka menggunakan elemen dengan massa yang lebih tinggi. Standar berikutnya adalah Oxygen-16. Kemudian, dengan penemuan keberadaan isotop oksigen dan masalah lain yang terkait dengannya, unit massa atom diukur relatif terhadap isotop karbon-12.
Apa itu massa atom?
Atom terutama mengandung proton, neutron dan elektron. Massa atom hanyalah massa atom. Dengan kata lain, ini adalah kumpulan massa dari semua neutron, proton dan elektron dalam satu atom, khususnya, ketika atom tidak bergerak (massa istirahat). Kita harus mengambil massa sisanya karena, menurut dasar -dasar fisika, ketika atom bergerak dengan kecepatan sangat tinggi, massa meningkat.
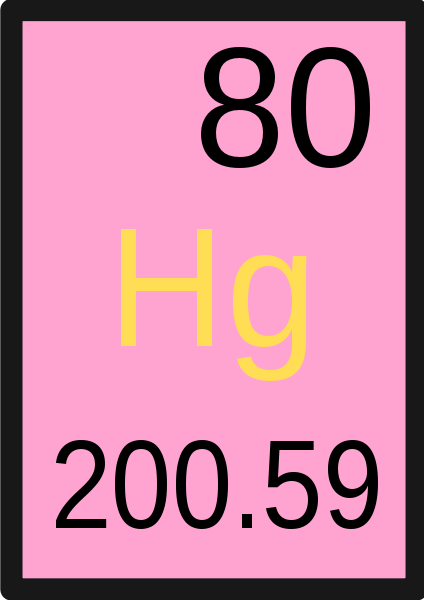
Gambar 01: Massa atom merkuri adalah 200.59 Amu
Namun, massa elektron sangat kecil dibandingkan dengan massa proton dan neutron. Oleh karena itu, kita dapat mengatakan bahwa kontribusi elektron terhadap massa atom lebih sedikit. Sebagian besar atom dalam tabel periodik memiliki dua atau lebih isotop. Isotop berbeda satu sama lain dengan memiliki jumlah neutron yang berbeda, meskipun mereka memiliki jumlah proton dan elektron yang sama. Karena jumlah neutron mereka berbeda, setiap isotop memiliki massa atom yang berbeda. Rata -rata seluruh massa isotop adalah berat atom. Oleh karena itu, massa isotop spesifik adalah massa atom dalam atom, yang memiliki beberapa isotop.
Apa perbedaan antara unit massa atom dan massa atom?
Massa atom adalah massa atom tertentu (tanpa mengambil massa rata -rata isotop). Unit massa atom adalah 1/12 dari massa karbon -12 isotop. Oleh karena itu, perbedaan utama antara unit massa atom dan massa atom adalah bahwa unit massa atom adalah unit yang kami gunakan untuk mengukur massa atom sedangkan massa atom adalah massa atom tunggal tertentu. Selain itu, kita dapat menggunakan unit massa atom untuk menunjukkan massa relatif atom lain secara relatif terhadap massa C-12.
Infografis di bawah ini tentang perbedaan antara unit massa atom dan massa atom merangkum semua perbedaan ini.
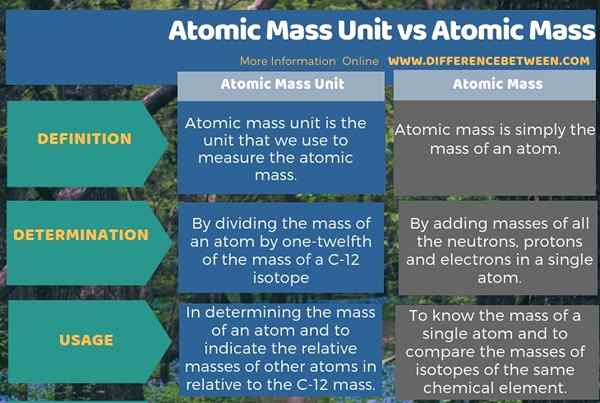
Ringkasan -Unit Massa Atom vs Massa Atom
Unit massa atom adalah unit pengukuran massa atom dari atom tunggal. Perbedaan utama antara unit massa atom dan massa atom adalah bahwa unit massa atom adalah unit yang kami gunakan untuk mengukur massa atom sedangkan massa atom adalah massa atom tunggal tertentu.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Massa atom dan nomor massa atom (ulasan cepat)."Thoughtco, Jun. 13, 2018. Tersedia disini
Gambar milik:
1."Merkurius (Elemen)" oleh saya (CC BY-SA 2.5) Via Commons Wikimedia


