Perbedaan antara berat atom dan massa atom
Itu perbedaan utama Antara berat atom dan massa atom adalah itu Berat atom adalah berat rata -rata suatu unsur, sehubungan dengan semua isotopnya dan kelimpahan relatifnya tetapi, massa atom adalah massa atom tunggal.
Kebanyakan orang menggunakan istilah massa atom dan berat atom secara bergantian. Namun, mereka memiliki makna yang berbeda, dan menyebabkan kesalahan yang signifikan dalam perhitungan material curah jika kita mengambil kedua istilah ini sebagai satu.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa berat atom
3. Apa itu massa atom
4. Perbandingan berdampingan - berat atom vs massa atom dalam bentuk tabel
5. Ringkasan
Apa berat atom?
Berat atom adalah berat rata -rata suatu unsur, sehubungan dengan semua isotopnya dan kelimpahan relatifnya. Sebagian besar waktu, elemen kimia memiliki isotop; Isotop adalah berbagai bentuk elemen kimia yang sama. Isotop memiliki jumlah proton yang sama (yang membuatnya termasuk dalam elemen kimia yang sama) dan jumlah neutron yang berbeda dalam nukleus atom. Ada persentase berbeda dari isotop berbeda yang terjadi di alam. Kita perlu mempertimbangkan massa atom dari semua isotop dan persentase mereka saat mendapatkan berat atom dari elemen kimia. Di sana, kita dapat menghitung massa rata -rata menggunakan massa atom masing -masing isotop untuk mendapatkan berat atom. Berat atom yang kita lihat dalam tabel periodik dihitung sesuai dengan fenomena ini.
Kita dapat menggunakan dua langkah berikut untuk perhitungan ini;
- Pertama, mengubah persentase menjadi nilai desimal dengan membaginya dengan 100.
- Selanjutnya, kalikan massa atom dari masing -masing isotop dari nilai desimal ini sesuai.
- Akhirnya, tambahkan jawaban bersama untuk mendapatkan jawaban terakhir.
Video 1: Menghitung berat atom
Contoh: Misalkan kita memiliki 98% isotop C-12 dan 2% dari isotop C-13 di alam. Mari kita hitung berat atom karbon menggunakan massa atom dari isotop ini.
- Konversi menjadi nilai desimal:
- Nilai desimal untuk persentase C-12 adalah 0.98 (diperoleh dengan membagi 98 dari 100).
- Nilai desimal untuk persentase C-13 adalah 0.02 (diperoleh dengan membagi 2 dari 100).
- Penggandaan massa atom masing -masing isotop dari nilai desimal:
- 12 x 0.98 = 11.76
- 13 x 0.02 = 0.26
- Penambahan jawaban bersama untuk mendapatkan jawaban terakhir:
- 76 + 0.26 = 12.02
Akhirnya, kita bisa mendapatkan berat atom karbon elemen kimia sebagai 12.02 AMU (unit massa atom). Selain itu, kita dapat menyebut istilah ini sebagai "massa atom relatif" karena itu adalah rata -rata massa atom isotop aktual.
Apa itu massa atom?
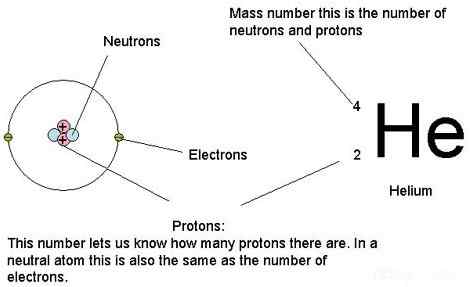
Atom terutama mengandung proton, neutron dan elektron. Massa atom hanyalah massa atom. Dengan kata lain, ini adalah kumpulan massa dari semua neutron, proton dan elektron dalam satu atom, khususnya, ketika atom tidak bergerak (massa istirahat). Kami hanya mengambil massa sisanya karena menurut dasar -dasar fisika ketika atom bergerak pada kecepatan yang sangat tinggi, massa meningkat. Namun, massa elektron sangat kecil dibandingkan dengan massa proton dan neutron. Oleh karena itu, kita dapat mengatakan bahwa kontribusi elektron terhadap massa atom lebih sedikit. Oleh karena itu kita dapat mengabaikan massa elektron saat menghitung massa atom. Di atas segalanya, isotop yang berbeda memiliki massa atom yang berbeda meskipun mereka termasuk elemen kimia yang sama karena mereka memiliki jumlah neutron yang berbeda.

Gambar 01: Kita dapat menggunakan massa proton, neutron dan elektron atom untuk menghitung massa atom
Selain itu, massa atom sangat kecil, jadi kami tidak dapat mengekspresikannya dalam unit massa normal seperti gram atau kilogram. Untuk tujuan kami, kami menggunakan unit unit atom unit atom (AMU) untuk mengukur massa atom. Demikian pula, 1 unit massa atom adalah seperempat dari massa isotop C-12. Ketika kita membagi massa atom dari massa seperempat dari massa isotop C-12, kita bisa mendapatkan massa relatifnya. Namun, dalam penggunaan umum ketika kita mengatakan massa atom relatif dari suatu unsur, kita maksudkan berat atom mereka (karena kita menghitungnya dengan mempertimbangkan semua isotop).
Apa perbedaan antara berat atom dan massa atom?
Sebagian besar waktu kami menggunakan istilah berat atom dan massa atom dengan sama. Namun, kedua istilah ini berbeda satu sama lain terutama sesuai dengan definisi. Oleh karena itu, dengan definisi, perbedaan utama antara berat atom dan massa atom adalah bahwa berat atom adalah berat rata -rata suatu unsur, sehubungan dengan semua isotopnya dan kelimpahan relatifnya sedangkan massa atom adalah massa atom tunggal tunggal.
Selain itu, kita dapat mengidentifikasi perbedaan penting lainnya antara berat atom dan massa atom dengan mempertimbangkan cara menghitung setiap nilai; Kita harus menghitung berat atom menggunakan persentase kelimpahan semua isotop elemen kimia di alam sementara kita dapat menghitung massa atom hanya dengan menambahkan massa proton, neutron dan elektron atom.
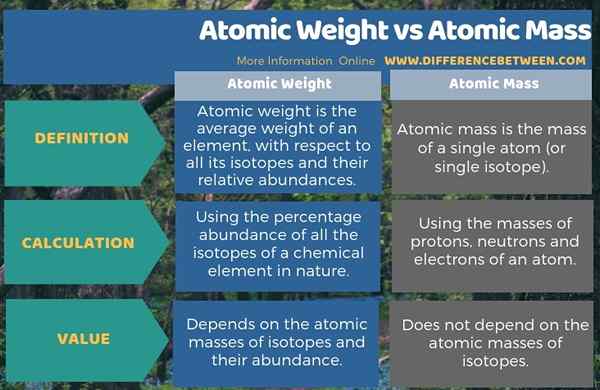
Ringkasan -berat atom vs massa atom
Berat atom dan massa atom adalah dua istilah penting yang sering kita gunakan dalam perhitungan kimia. Perbedaan utama antara berat atom dan massa atom adalah bahwa berat atom adalah berat rata -rata suatu unsur, sehubungan dengan semua isotopnya dan kelimpahan relatifnya sedangkan massa atom adalah massa atom tunggal.
Referensi:
1. Wichers, Edward, dan H. Steffen Peiser. “Berat atom.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 15 Des. 2017. Tersedia disini
2. Helmenstine, Anne Marie, PH.D. “Cara menghitung massa atom."Thoughtco, Apr. 1, 2018. Tersedia disini
Gambar milik:
1."133317385" oleh Elearn.Punjab (CC0) melalui Vimeo
2."Penggambaran Nomor Atom" oleh MaterialScientist (CC0) melalui Commons Wikimedia


