Perbedaan antara berat atom dan jumlah massa
Itu perbedaan utama Antara berat atom dan jumlah massa adalah Berat atom adalah massa rata -rata yang dihitung mengingat semua isotop sedangkan jumlah massa adalah massa isotop spesifik.
Kita dapat mengkarakterisasi atom dengan angka atom dan angka massa mereka. Dalam tabel periodik, atom diatur sesuai dengan nomor atomnya. Jumlah massa elemen terkait dengan massanya. Namun, itu tidak memberikan massa atom yang tepat. Berat atom adalah cara lain untuk mengekspresikan berat atom, tetapi ini berbeda dari massa atom. Namun, penting untuk mengidentifikasi makna terminologi ini secara terpisah, karena mereka dapat membuat perbedaan besar dalam pengukuran jika kita menggunakannya secara bergantian.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa berat atom
3. Berapa angka massa
4. Perbandingan berdampingan -berat atom vs angka massa dalam bentuk tabel
5. Ringkasan
Apa berat atom?
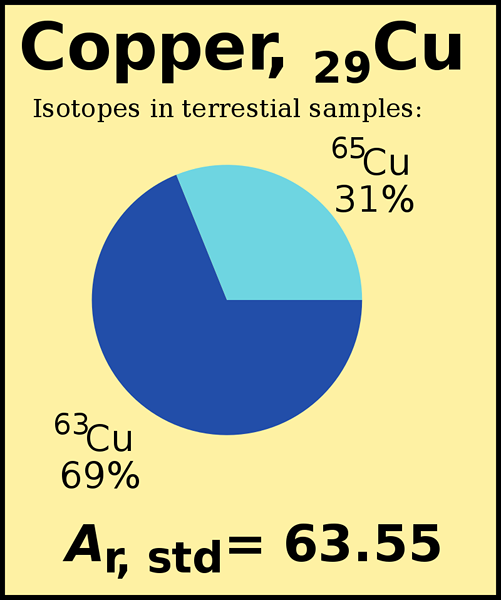
Atom terutama mengandung proton, neutron, dan elektron. Massa atom hanyalah massa atom. Sebagian besar atom dalam tabel periodik memiliki dua atau lebih isotop. Isotop berbeda satu sama lain dengan memiliki jumlah neutron yang berbeda meskipun mereka memiliki jumlah proton dan elektron yang sama. Karena jumlah neutron mereka berbeda, setiap isotop memiliki massa atom yang berbeda. Berat atom adalah berat rata -rata yang kami hitung mempertimbangkan semua massa isotop. Setiap isotop hadir di lingkungan, dalam persentase yang berbeda. Saat menghitung berat atom, kita perlu mempertimbangkan massa isotop dan kelimpahan relatifnya.

Gambar 01: Berat atom standar tembaga
Selain itu, massa atom sangat kecil, jadi kami tidak dapat mengekspresikannya dalam unit massa normal seperti gram atau kilogram. Bobot yang diberikan dalam tabel periodik dihitung seperti di atas dan diberikan sebagai massa atom relatif.
Namun, definisi IUPAC untuk berat atom adalah sebagai berikut:
“Berat atom (massa atom relatif) dari suatu unsur dari sumber yang ditentukan adalah rasio massa rata -rata per atom elemen hingga 1/12 dari massa atom 12c."
Massa isotop yang paling berlimpah berkontribusi lebih banyak terhadap berat atom. Misalnya, kelimpahan alami CL-35 adalah 75.76%, sedangkan kelimpahan CL-37 adalah 24.24%. Berat atom klorin adalah 35.453 (Amu), yang lebih dekat dengan massa isotop CL-35.
Berapa angka massa?
Jumlah massa adalah jumlah total neutron dan proton dalam inti atom. Kami biasanya menyebut koleksi neutron dan proton sebagai nukleon. Oleh karena itu, kita dapat mendefinisikan jumlah massa juga sebagai jumlah nukleon dalam inti atom.
Biasanya, kami menunjukkan nilai ini di sudut kiri atas elemen (sebagai superscript) sebagai nilai integer. Isotop yang berbeda memiliki jumlah massa yang berbeda karena neutronnya bervariasi. Dengan demikian, jumlah massa suatu elemen memberikan massa elemen pada bilangan bulat. Perbedaan antara jumlah massa dan jumlah atom suatu elemen memberikan jumlah neutronnya.
Apa perbedaan antara berat atom dan jumlah massa?
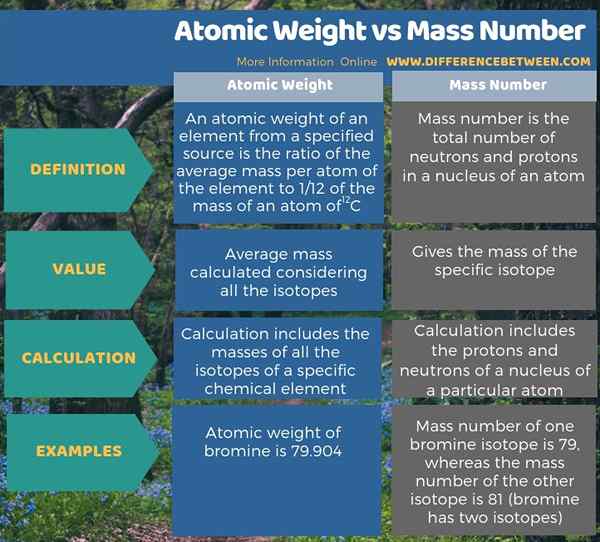
Perbedaan utama antara berat atom dan jumlah massa adalah bahwa berat atom adalah massa rata -rata yang dihitung dengan mempertimbangkan semua isotop sedangkan jumlah massa memberikan massa isotop spesifik. Sebagian besar waktu, jumlah massa sangat berbeda dari berat atom. Misalnya, bromin memiliki dua isotop. Jumlah massa satu isotop adalah 79, sedangkan jumlah massa isotop lainnya adalah 81. Selain itu, berat atom bromin adalah 79.904, yang berbeda dari kedua massa isotop.
Ringkasan -berat atom vs jumlah massa
Berat atom dan jumlah massa adalah dua konsep yang berbeda dalam kimia. Perbedaan utama antara berat atom dan jumlah massa adalah bahwa berat atom adalah massa rata -rata yang dihitung dengan mempertimbangkan semua isotop sedangkan jumlah massa memberikan massa isotop spesifik.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Massa Atom: Berat Atom."Thoughtco, Jan. 22, 2019, tersedia di sini.
Gambar milik:
1. “Ciaaw 2013 - berat atom standar untuk Cupper (29, Cu)” oleh DePIEP - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


