Perbedaan antara autoionisasi dan autoprotolisis
Itu perbedaan utama Antara autoionisasi dan autoprotolisis adalah itu Autoionisasi adalah konversi keadaan netral dari spesies kimia menjadi keadaan terionisasi sedangkan autoprotolisis adalah transfer proton antara dua spesies kimia yang identik untuk membentuk bentuk terionisasi.
Kedua istilah autoionisasi dan autoprotolisis menggambarkan dua metode pembentukan spesies terionisasi, i.e. kation dan anion. Ini adalah reaksi spontan di mana ionisasi terjadi tanpa efek faktor eksternal.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu autoionisasi
3. Apa itu autoprotolisis
4. Perbandingan Berdampingan - Autoionisasi vs Autoprotolisis Dalam Bentuk Tabel
5. Ringkasan
Apa itu autoionisasi?
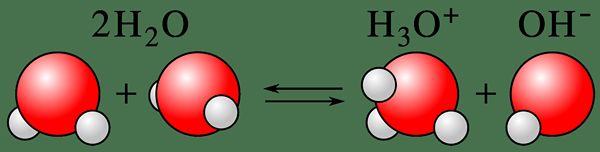
Autoionisasi adalah proses mengubah keadaan netral dari spesies kimia menjadi keadaan terionisasi. Istilah ini biasanya menggambarkan ionisasi molekul air. Oleh karena itu, kita dapat menyebutnya alialisasi air atau disosiasi air secara otomatis juga. Di sini, molekul air terdeprotonasi untuk membentuk ion hidroksida, oh- dan ion hidrogen, h+ (proton). Di sini, deprotonasi segera memproton molekul air lain dan mengarah pada pembentukan ion hidronium (H3O+). Jadi, proses ini adalah contoh yang baik dari sifat amfoterik air.

Gambar 01: Ionisasi molekul air
Selanjutnya, proses ini menggambarkan sifat amfoterik air. Sifat amfoter berarti bahwa air dapat bertindak sebagai asam dan basa karena autoionisasi membentuk proton dan ion hidroksida, yang memberi air kemampuan untuk menetralkan asam dan basa sedikit; Misalnya, ion hidronium atau h3HAI+ ion dapat menetralkan basa ringan, dan ion hidroksida dapat menetralkan asam ringan.
Apa itu autoprotolisis?
Autoprotolisis adalah proses transfer proton antara spesies kimia yang identik untuk membentuk spesies terionisasi. Di sini, salah satu dari dua molekul yang identik bertindak sebagai asam Brønsted, dan melepaskan proton. Molekul lain dapat menerima proton ini. Oleh karena itu, molekul lain ini bertindak sebagai basis Brønsted. Ionisasi air adalah contoh untuk autoprotolisis. Selain itu, istilah ini berbeda dari autoprotonolisis karena autoprotonolisis menggambarkan pembelahan ikatan kimia oleh asam.
Beberapa contoh lain dari senyawa kimia yang menjalani autoprotolisis termasuk amonia dan asam asetat;
Autoprotolisis amonia:
2nh3 ⇌ nh2- + NH4+
Autoprotolisis asam asetat:
2ch3Cooh ⇌ ch3MENDEKUT- + Ch3Cooh2+
Apa perbedaan antara autoionisasi dan autoprotolisis?
Autoionisasi dan autoprotolisis adalah reaksi spontan. Perbedaan utama antara autoionisasi dan autoprotolisis adalah bahwa autoionisasi adalah konversi keadaan netral spesies kimia menjadi keadaan terionisasi sedangkan autoprotolisis adalah transfer proton antara dua spesies kimia yang identik untuk membentuk bentuk terionisasi. Contoh autoionisasi adalah air saat air, amonia, asam asetat adalah beberapa contoh untuk autoprotolisis.
Selain itu, dalam proses autoionisasi (juga dikenal sebagai alionisasi air atau disosiasi otomatis), molekul air terdeprotonasi untuk membentuk ion hidroksida, OH- dan ion hidrogen, H+ (proton), sedangkan dalam proses dari Autoprotolisis, salah satu dari dua molekul identik yang terlibat bertindak sebagai asam Brønsted dan melepaskan proton yang diterima oleh molekul lain yang bertindak sebagai basis Brønsted. Selain itu, proses autoionisasi air menggambarkan sifat amfoter (ia dapat menetralkan kedua asam ringan dan basa ringan) dari air. Di sisi lain, autoprotolisis menggambarkan sifat amfoter senyawa kimia seperti air, asam asetat dan amonia.
Infografis di bawah ini merangkum perbedaan antara autoionisasi dan autoprotolisis.
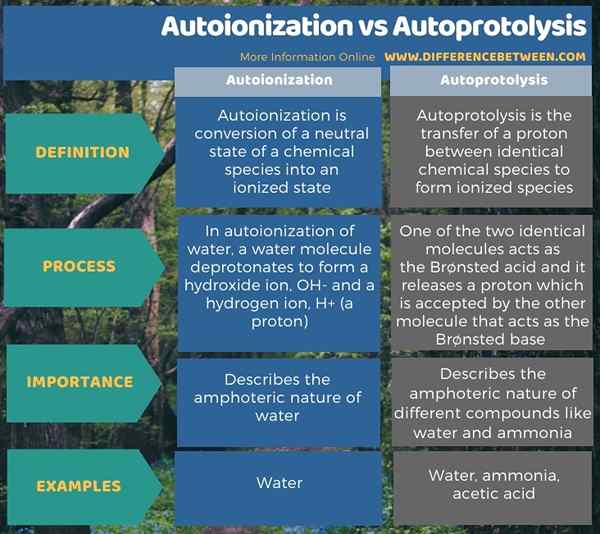
Ringkasan -Autoionisasi vs Autoprotolisis
Autoionisasi dan autoprotolisis adalah reaksi spontan. Perbedaan utama antara autoionisasi dan autoprotolisis adalah bahwa autoionisasi adalah konversi keadaan netral spesies kimia menjadi keadaan terionisasi sedangkan autoprotolisis adalah transfer proton antara dua spesies kimia yang identik untuk membentuk bentuk terionisasi.
Referensi:
1. “Ionisasi air.”Wikipedia, Wikimedia Foundation, 3 Juni 2019, tersedia di sini.
2. “Autoprotolisis."Wikipedia, Wikimedia Foundation, 24 September. 2019, tersedia di sini.
3. “Autoionisasi air.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "Autoprotolyse Eau" oleh Cdang - karya sendiri (domain publik) melalui Commons Wikimedia


