Perbedaan antara persamaan seimbang dan persamaan kerangka
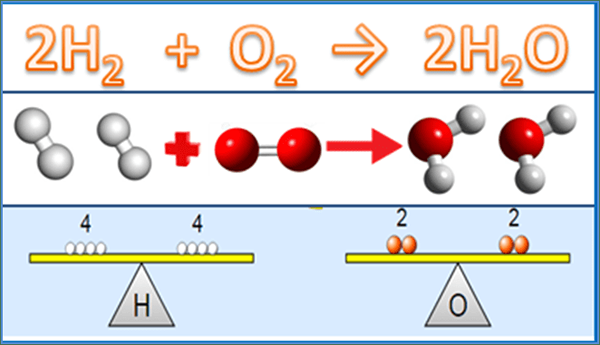
Perbedaan utama antara persamaan seimbang dan persamaan kerangka adalah bahwa Persamaan yang seimbang memberikan jumlah aktual molekul dari masing -masing reaktan dan produk yang terlibat dalam reaksi kimia sedangkan persamaan kerangka hanya memberikan reaktan reaksi.
Persamaan kimia adalah representasi dari reaksi kimia. Itu berarti; Persamaan kimia memberikan reaktan reaksi, produk akhir dan arah reaksi juga. Ada dua jenis persamaan sebagai persamaan seimbang dan persamaan kerangka.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa persamaan yang seimbang
3. Apa itu persamaan kerangka
4. Perbandingan Berdampingan - Persamaan Balanced Vs Skeleton Persamaan dalam Bentuk Tabel
5. Ringkasan
Apa persamaan yang seimbang?
Persamaan kimia yang seimbang memberikan jumlah aktual dari setiap reaktan yang bereaksi satu sama lain dan jumlah molekul produk yang terbentuk. Ini adalah persamaan yang sepenuhnya terperinci yang memberikan rasio antara reaktan dan produk. Saat menghitung parameter seperti jumlah produk yang kita peroleh dari reaksi, kita harus menggunakan persamaan kimia seimbang; Kalau tidak, kita tidak akan tahu berapa banyak reaktan yang bereaksi untuk memberikan berapa banyak produk.

Namun, dalam perhitungan termodinamika, persamaan ini tidak berfungsi ketika menentukan urutan reaksi karena kita harus menentukan urutan reaksi pada dasarnya melalui metode eksperimental. Dalam persamaan kimia yang seimbang, nilai -nilai di depan molekul disebut "koefisien stoikiometrik"; Stoikiometri adalah hubungan numerik antara reaktan dan produk.
2NA2O ⟶ 4NA +O2
Reaksi di atas adalah contoh persamaan kimia yang seimbang. Ini memberikan dekomposisi natrium oksida (NA2HAI). Persamaan normal atau persamaan kerangka dari reaksi ini adalah Na2O ⟶ na + o2. Saat menyeimbangkan persamaan, kita dapat menggunakan dua metode: metode inspeksi dan metode bilangan oksidasi.
Metode inspeksi termasuk menyeimbangkan persamaan kimia dengan melihat reaktan dan produk. Dalam reaksi ini, natrium oksida adalah reaktan, dan memiliki dua atom natrium dan satu atom oksigen per molekul. Tetapi di sisi produk, ada satu atom natrium dan dua atom oksigen. Oleh karena itu, pertama -tama, kita dapat menambahkan koefisien stoikiometrik ke sisi reaktan; itu 2. Kemudian, di sisi reaktan, ada empat atom natrium dan dua atom oksigen. Karena ada dua atom oksigen di sisi produk juga, kami hanya dapat menambahkan "4" sebagai koefisien stoikiometrik natrium di sisi produk untuk menyeimbangkan persamaan ini. Sekarang jumlah atom di setiap sisi sama; Dengan demikian, kami mendapatkan persamaan kimia yang seimbang.
Apa itu persamaan kerangka?
Persamaan kerangka memberikan jenis reaktan yang terlibat dalam reaksi kimia dan produk akhir. Namun, ini tidak memberikan rasio yang tepat antara reaktan dan produk. Oleh karena itu, detail penting yang bisa kita dapatkan dari persamaan kerangka adalah reaktan reaksi, produk reaksi dan arah reaksi. Untuk reaksi di atas, reaksi kerangka adalah sebagai berikut;
Na2O ⟶ na +o2
Apa perbedaan antara persamaan seimbang dan persamaan kerangka?
Perbedaan utama antara persamaan seimbang dan persamaan kerangka adalah bahwa persamaan seimbang memberikan jumlah aktual molekul masing -masing reaktan dan produk yang terlibat dalam reaksi kimia, sedangkan persamaan kerangka hanya memberikan reaktan reaksi pada reaksi tersebut. Selain itu, persamaan yang seimbang mungkin atau mungkin tidak mengandung koefisien stoikiometrik sementara persamaan kerangka tidak memiliki koefisien stoikiometrik. Misalnya, persamaan kimia yang seimbang untuk dekomposisi natrium oksida adalah 2NA2O ⟶ 4NA + O2 Sedangkan persamaan kerangka adalah na2O ⟶ na + o2.
Infografis di bawah ini merangkum perbedaan antara persamaan seimbang dan persamaan kerangka.

Ringkasan -persamaan persamaan vs kerangka seimbang
Persamaan yang seimbang dan persamaan kerangka adalah dua cara menulis persamaan kimia untuk reaksi kimia tertentu. Singkatnya, perbedaan utama antara persamaan yang seimbang dan persamaan kerangka adalah bahwa persamaan yang seimbang memberikan jumlah aktual molekul masing -masing reaktan dan produk yang terlibat dalam reaksi kimia, sedangkan persamaan kerangka hanya memberikan reaktan reaksi tersebut.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh persamaan yang seimbang."Thoughtco, SEP. 17, 2019, tersedia di sini.
Gambar milik:
1. “Menyeimbangkan Persamaan Kimia - Pembentukan Air” oleh KVR.Lohith - Pekerjaan Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


