Perbedaan antara asam biner dan asam polyatomic
Itu perbedaan utama Antara asam biner dan asam polyatomic adalah itu Asam biner mengandung atom dari hanya dua elemen kimia yang berbeda, sedangkan asam polyatomic mengandung atom dari dua atau lebih elemen kimia yang berbeda.
Asam adalah senyawa kimia anorganik yang dapat menetralkan zat alkali. Asam mampu melarutkan sebagian besar logam. Kita dapat dengan mudah mengidentifikasi asam menggunakan kertas lak - perubahan lakmus biru menjadi warna merah setelah merendamnya dengan asam. Ada berbagai jenis asam; Asam biner dan asam polyatomic adalah dua jenis tersebut.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam biner
3. Apa itu asam polyatomic
4. Perbandingan berdampingan - asam biner vs asam polyatomic dalam bentuk tabel
5. Ringkasan
Apa itu asam biner?
Asam biner adalah zat anorganik yang memiliki ikatan hidrogen dengan elemen kimia lain. Elemen kimia kedua ini sebagian besar merupakan elemen non -logam. Istilah "biner" mengacu pada suatu zat yang memiliki komponen "dua" dari sesuatu; Dalam konteks ini, ini adalah dua elemen kimia yang berbeda. Keasaman zat ini muncul karena kemampuannya untuk melepaskan hidrogen sebagai kation atau proton, yang menyebabkan keasaman larutan berairnya. Asam biner yang paling umum termasuk asam hidrofluorat (HF), asam hidroklorat (HCl), dan asam hidrobromida (HBR). Selain itu, asam biner mungkin memiliki satu atau lebih atom hidrogen per molekul, tergantung pada valensi non -logam yang terikat pada atom hidrogen, e.G. H2S.
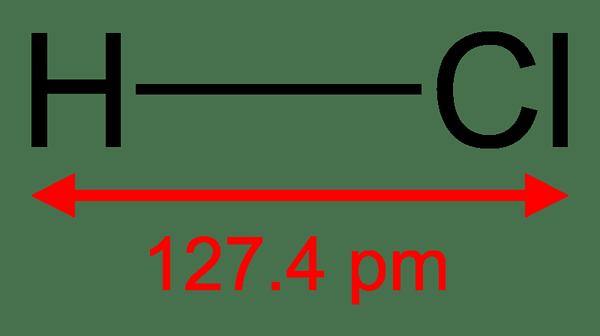
Gambar 01: Hidrogen klorida
Asam biner bisa berupa asam kuat, asam lemah atau asam sedang. Kekuatan asam ini tergantung pada kekuatan ikatan kovalen antara atom hidrogen dan atom non -logam. Karena semua asam biner mengandung atom hidrogen, nama asam biner dimulai dengan "hidro-".
Apa itu asam polyatomic?
Asam polyatomic adalah senyawa anorganik yang mengandung atom dengan dua atau lebih elemen kimia yang berbeda. Namun, ion yang terbentuk dari disosiasi asam polyatomic dapat berupa monoatomik atau polyatomik karena beberapa asam polyatomic hanya memiliki dua elemen kimia yang berbeda dan pengangkatan atom hidrogen membentuk ion monoatomik.

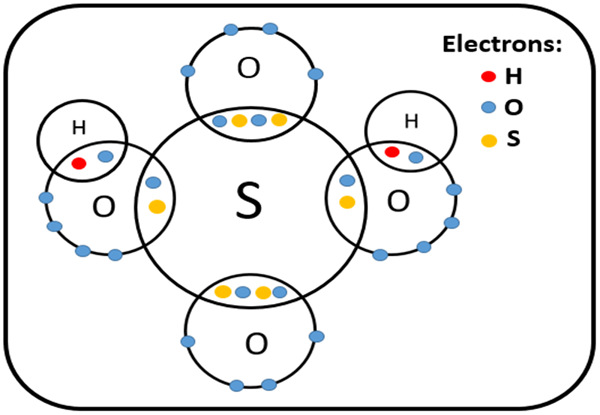
Gambar 02: Struktur asam sulfat
Beberapa contoh umum asam polyatomic termasuk asam karbonat (H2CO3), asam sulfat (H2SO4), asam belerang (H2SO3), asam nitrat (HNO3), dll.
Apa perbedaan antara asam biner dan asam politisomat?
Asam adalah zat yang dapat menetralkan zat basa. Perbedaan utama antara asam biner dan asam polyatomic adalah bahwa asam biner mengandung atom dari hanya dua elemen kimia yang berbeda, sedangkan asam politisomat mengandung atom dari dua atau lebih elemen kimia yang berbeda.
Selain itu, asam biner selalu membentuk basa konjugat monoatomik, sedangkan asam polyatomic dapat membentuk basa konjugat monoatomik atau basa politisomik. Juga, asam biner sebagian besar adalah asam kuat hingga sedang. Asam hidrofluorat (HF), asam hidroklorat (HCl), dan asam hidrobromida (HBR) adalah beberapa contoh asam biner. Asam polyatomic, di sisi lain, dapat berupa asam yang kuat, asam lemah atau senyawa asam sedang. Beberapa contoh termasuk asam karbonat (H2CO3), asam sulfat (H2SO4), dan asam nitrat (HNO3).
Di bawah infografis tabulasi berdampingan perbedaan antara asam biner dan asam polyatomic.
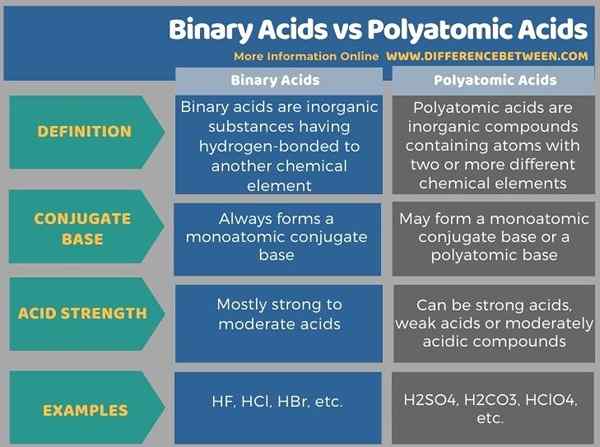
Ringkasan -Asam biner vs asam polyatomic
Kami dapat dengan mudah mengidentifikasi asam menggunakan kertas lakmus; lakmus biru berubah merah saat direndam dengan asam. Ada berbagai jenis asam, seperti asam biner dan asam polyatomic. Perbedaan utama antara asam biner dan asam polyatomic adalah bahwa asam biner mengandung atom dari hanya dua elemen kimia yang berbeda, sedangkan asam politisomat mengandung atom dari dua atau lebih elemen kimia yang berbeda.
Referensi:
1. Helmenstine, Anne Marie. “Apa itu asam dan basa?"Thoughtco, Aug. 26, 2020, tersedia di sini.
2. “5.9: Penamaan asam.”Kimia Libretexts, Libretexts, 20 Nov. 2020, tersedia di sini.
Gambar milik:
1. “Hidrogen-Chloride-2D-dimensi” (domain publik) via Commons Wikimedia
2. "H2SO4 PIC" oleh Jadder1224 - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


