Perbedaan antara energi ikatan dan energi disosiasi ikatan
Itu perbedaan utama antara energi ikatan dan energi disosiasi ikatan adalah bahwa Energi obligasi adalah nilai rata -rata sedangkan energi disosiasi obligasi adalah nilai tertentu untuk obligasi tertentu.
Seperti yang diusulkan oleh ahli kimia Amerika G.N.Lewis, atom stabil ketika mengandung delapan elektron di cangkang valensi mereka. Sebagian besar atom memiliki kurang dari delapan elektron dalam cangkang valensi mereka (kecuali gas mulia di kelompok 18 dari tabel periodik); Oleh karena itu, mereka tidak stabil. Oleh karena itu, atom -atom ini cenderung bereaksi satu sama lain, menjadi stabil. Itu dapat terjadi dengan membentuk ikatan ionik, ikatan kovalen atau ikatan logam tergantung pada elektronegativitas atom. Ketika dua atom memiliki perbedaan elektronegativitas yang serupa atau sangat rendah, bereaksi bersama, mereka membentuk ikatan kovalen dengan berbagi elektron. Energi ikatan dan energi disosiasi ikatan adalah dua konsep tentang ikatan kimia kovalen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi ikatan
3. Apa itu energi disosiasi ikatan
4. Perbandingan Berdampingan - Energi Bond Energi vs Energi Disosiasi Obligasi dalam bentuk tabel
5. Ringkasan
Apa itu energi ikatan?
Saat obligasi terbentuk, sejumlah rilis energi. Sebaliknya, pemecahan ikatan membutuhkan sejumlah energi. Untuk ikatan kimia tertentu, energi ini konstan. Dan kami menyebutkannya sebagai energi ikatan. Dengan demikian, energi ikatan adalah jumlah panas yang dibutuhkan untuk memecah satu mol molekul menjadi atom yang sesuai.
Selain itu, kita dapat mengamati energi ikatan kimia dalam berbagai bentuk sebagai energi kimia, energi mekanik atau energi listrik. Namun, pada akhirnya, semua energi ini dikonversi menjadi panas. Oleh karena itu, kita dapat mengukur energi ikatan dalam kilojoule atau kilocalorie.

Gambar 01: Energi Bond
Selanjutnya, energi ikatan adalah indikator kekuatan ikatan. Misalnya, ikatan yang lebih kuat sulit dibelah. Oleh karena itu, energi ikatan mereka lebih besar. Di sisi lain, ikatan lemah memiliki energi ikatan kecil, dan mudah untuk dibelah. Energi ikatan juga menunjukkan jarak ikatan. Energi ikatan yang lebih tinggi berarti jarak ikatan rendah (oleh karena itu, kekuatan ikatan tinggi). Selanjutnya, ketika energi ikatan adalah jarak ikatan yang rendah lebih tinggi. Seperti yang disebutkan dalam pendahuluan elektronegativitas berperan dalam pembentukan ikatan. Oleh karena itu, elektronegativitas atom juga berkontribusi pada energi ikatan.
Apa itu energi disosiasi ikatan?
Energi disosiasi ikatan juga merupakan pengukuran kekuatan ikatan. Kita dapat mendefinisikannya sebagai perubahan entalpi yang terjadi ketika ikatan mengalami pembelahan dengan homolisis. Energi disosiasi ikatan khusus untuk satu ikatan.
Dalam hal ini, ikatan yang sama dapat memiliki energi disosiasi ikatan yang berbeda tergantung pada situasinya. Misalnya, ada empat ikatan C-H dalam molekul metana, dan semua ikatan C-H tidak memiliki energi disosiasi ikatan yang sama.

Gambar 02: Beberapa energi disosiasi ikatan untuk kompleks koordinasi
Oleh karena itu, dalam molekul metana, energi disosiasi ikatan untuk ikatan C-H adalah 439 kJ/mol, 460 kJ/mol, 423 kJ/mol dan 339 kJ/mol. Itu karena kerusakan ikatan pertama membentuk spesies radikal melalui homolisis, sehingga kerusakan ikatan kedua terjadi dari spesies radikal, yang membutuhkan lebih banyak energi yang pertama. Demikian juga, langkah demi langkah energi disosiasi ikatan berubah.
Apa perbedaan antara energi ikatan dan energi disosiasi ikatan?
Energi ikatan adalah nilai rata-rata energi disosiasi ikatan gas-fase (biasanya pada suhu 298 K) untuk semua ikatan dari jenis yang sama dalam spesies kimia yang sama. Namun, energi ikatan dan energi disosiasi ikatan tidak sama. Energi disosiasi ikatan adalah perubahan entalpi standar ketika ikatan kovalen dibelah oleh homolisis untuk memberikan fragmen; yang biasanya merupakan spesies radikal. Oleh karena itu, perbedaan utama antara energi ikatan dan energi disosiasi ikatan adalah bahwa energi ikatan adalah nilai rata -rata sedangkan energi disosiasi ikatan adalah nilai tertentu untuk ikatan tertentu.
Misalnya, dalam molekul metana, energi disosiasi ikatan untuk ikatan C-H adalah 439 kJ/mol, 460 kJ/mol, 423 kJ/mol dan 339 kJ/mol. Namun, energi ikatan C-H metana adalah 414 kJ/mol, yang merupakan rata-rata dari keempat nilai. Lebih lanjut, untuk molekul, energi disosiasi ikatan mungkin tidak selalu sama dengan energi ikatan (seperti untuk contoh metana yang diberikan di atas). Untuk molekul diatomik, energi ikatan dan energi disosiasi ikatan adalah sama.
Di bawah infografis tentang perbedaan antara energi ikatan dan energi disosiasi ikatan memberikan rincian lebih lanjut tentang perbedaan.
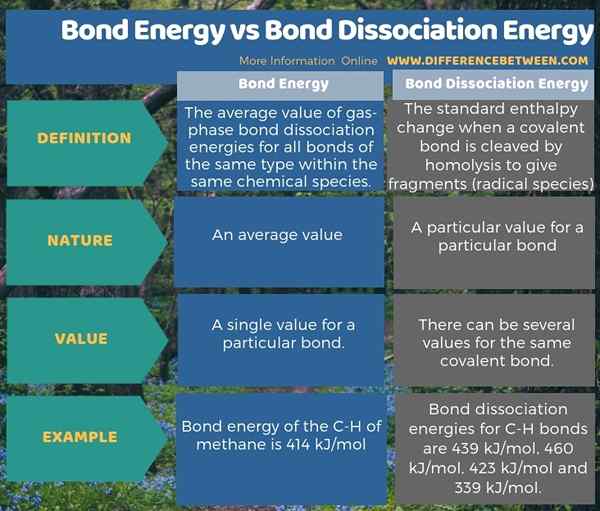
Ringkasan -Energi Energi Bond vs Energi Disosiasi Obligasi
Energi disosiasi ikatan berbeda dari energi ikatan. Energi ikatan adalah nilai rata -rata dari semua energi disosiasi ikatan dari suatu molekul. Oleh karena itu, perbedaan utama antara energi ikatan dan energi disosiasi ikatan adalah bahwa energi ikatan adalah nilai rata -rata sedangkan energi disosiasi ikatan adalah nilai tertentu untuk ikatan tertentu.
Referensi:
1. “Energi Disosiasi Obligasi.”Wikipedia, Wikimedia Foundation, 5 Jan. 2019. Tersedia disini
2. Libretexts. “Energi Bond."Kimia Libretexts, National Science Foundation, 26 Nov. 2018. Tersedia disini
Gambar milik:
1."Diagram Energi Bond" oleh FBarreyro - karya sendiri, (domain publik) via Commons Wikimedia
2."Energi Obligasi" oleh Chem540F09GRP8 - Pekerjaan Sendiri, (Domain Publik) Via Commons Wikimedia


