Perbedaan antara bromin dan bromida

Itu perbedaan utama antara bromin dan bromida adalah itu Bromida adalah bentuk brom yang berkurang.
Elemen kimia dalam tabel periodik tidak stabil kecuali untuk gas mulia. Oleh karena itu, elemen mencoba bereaksi dengan elemen lain untuk mendapatkan konfigurasi elektron gas mulia untuk mencapai stabilitas. Demikian juga, Bromine juga harus mendapatkan elektron untuk mencapai konfigurasi elektron Krypton Gas Noble. Semua logam bereaksi dengan bromin, membentuk bromida. Bromin dan bromida memiliki sifat fisik dan kimia yang berbeda karena perubahan satu elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu bromin
3. Apa itu bromida
4. Perbandingan berdampingan - bromin vs bromida dalam bentuk tabel
5. Ringkasan
Apa itu bromin?
Bromin adalah elemen kimia dalam tabel periodik yang dilambangkan dengan BR. Itu adalah halogen (17th grup) di 4th periode tabel periodik. Jumlah atom bromin adalah 35; Dengan demikian, ia memiliki 35 proton dan 35 elektron. Konfigurasi elektronnya adalah [ar] 4s2 3d10 4p5. Sejak P Sublevel harus memiliki 6 elektron untuk mendapatkan konfigurasi elektron gas Noble Krypton, Bromine memiliki kemampuan untuk menarik elektron. Ini memiliki elektronegativitas tinggi, yaitu sekitar 2.96, menurut skala Pauling.
Berat atom bromin adalah 79.904 AMU. Di bawah suhu kamar, itu ada sebagai molekul diatomik (BR2). Juga, molekul diatomik ini adalah cairan warna merah-coklat. Bromin memiliki titik peleburan 265.8 K dan titik mendidih 332.0 k.
Sifat selanjutnya dari bromin
Di antara semua isotop bromin, BR-79 dan BR-81 adalah isotop yang paling stabil. Selanjutnya, elemen kimia ini sedikit larut dalam air tetapi larut dalam pelarut organik seperti kloroform. Selain itu, ia memiliki keadaan oksidasi 7, 5, 4, 3, 1, -1.
Reaktivitas kimia bromin terletak di antara klorin dan yodium. Bromin kurang reaktif daripada klorin tetapi lebih reaktif daripada yodium. Bromin menghasilkan ion bromida dengan mengambil satu elektron. Oleh karena itu, bromin berpartisipasi dalam pembentukan senyawa ionik dengan mudah. Sebenarnya, di alam, bromin ada sebagai garam bromida, bukan Br2.

Gambar 01: Bromine
Bromin dapat mengoksidasi anion elemen yang terletak di bawah bromin di tabel periodik. Namun, itu tidak dapat mengoksidasi klorida untuk memberikan klorin. Selain itu, kita dapat menghasilkan BR dengan mengobati air asin kaya bromida dengan gas klorin. Atau gas bromin dibentuk dengan mengobati HBR dengan asam sulfat. Bromin sangat berguna di laboratorium industri dan kimia. Senyawa bromida penting sebagai aditif bensin, untuk pestisida dan sebagai desinfektan dalam pemurnian air.
Apa itu bromida?
Bromida adalah anion yang terbentuk ketika bromin mengabstraksi elektron dari elemen elektropositif lain. Kita bisa mewakilinya dengan simbol br-. Ini adalah ion monovalen dengan muatan -1. Oleh karena itu, ia memiliki 36 elektron dan 35 proton.

Konfigurasi elektron bromida adalah [ar] 4s2 3d10 4p6. Itu ada dalam senyawa ionik seperti natrium bromida, kalsium bromida dan hbr. Itu juga ada secara alami dalam sumber air.
Apa perbedaan antara bromin dan bromida?
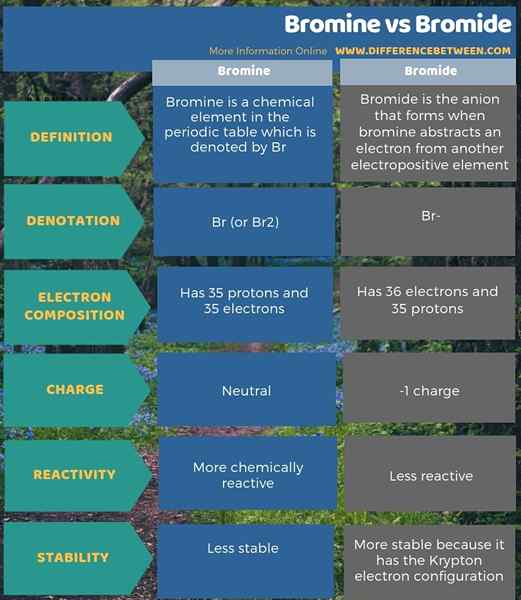
Bromin adalah elemen kimia dalam tabel periodik yang dilambangkan dengan BR sedangkan bromida adalah anion yang terbentuk ketika bromin abstrak elektron dari elemen elektropositif lain. Selain itu, perbedaan utama antara bromin dan bromida adalah bahwa bromida adalah bentuk bromin yang berkurang. Selain itu, bromida memiliki 36 elektron dibandingkan dengan 35 elektron bromin, tetapi keduanya memiliki 35 proton. Oleh karena itu, bromida memiliki muatan -1 sedangkan bromin netral.
Selain itu, bromin lebih reaktif secara kimia daripada bromida. Juga, perbedaan lebih lanjut antara bromin dan bromida adalah bahwa bromida telah mencapai konfigurasi elektron krypton dan, oleh karena itu, lebih stabil daripada atom bromin.
Ringkasan -Bromine vs Bromide
Bromin adalah elemen kimia dalam tabel periodik dan dilambangkan dengan BR. Sementara itu, bromida adalah anion yang terbentuk ketika bromin mengabstraksi elektron dari elemen elektropositif lain. Selanjutnya, perbedaan utama antara bromin dan bromida adalah bahwa bromida adalah bentuk bromin yang berkurang.
Gambar milik:
1. “Bromine 25ml (Transparan)” oleh W. Oelen -(CC BY -SA 3.0) Via Commons Wikimedia
2. "BR-" oleh NeuroTiker - pekerjaan sendiri (domain publik) melalui Commons Wikimedia


