Perbedaan antara karbokasi klasik dan non -klasik
Perbedaan utama antara karbokasi klasik dan non -klasik adalah bahwa Karbokasi klasik memiliki atom karbon yang memiliki enam elektron dalam tiga ikatan kimia, sedangkan karbokasi non-klasik memiliki struktur dua elektron tiga pusat.
Karbokasi adalah spesies kimia yang merupakan bagian dari molekul organik. Ini memiliki muatan positif pada atom karbon. Contoh sederhana karbokation adalah ch3+. Beberapa karbokation memiliki lebih dari satu muatan positif, pada atom karbon yang sama atau atom yang berbeda. Selain itu, karbokation adalah intermediet reaktif dalam reaksi organik karena adanya muatan positif; Ada enam elektron dalam atom karbon, yang membuatnya tidak stabil (keberadaan delapan elektron memastikan stabilitas); Oleh karena itu cenderung mencari elektron.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu karbokasi klasik
3. Apa itu karbokasi non -klasik
4. Perbandingan berdampingan - karbokasi klasik vs non -klasik dalam bentuk tabel
5. Ringkasan
Apa itu karbokasi klasik?
Karbokasi klasik adalah ion yang mengandung atom karbon bermuatan positif yang memiliki enam elektron yang mengambil bagian dalam tiga ikatan kimia. Kita dapat menyebutkan atom karbon ini sebagai karbon positif tiga koordinasi.
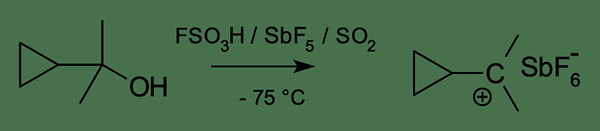
Gambar 01: Pembentukan karbokasi klasik
Untuk memastikan stabilitas maksimum, atom karbon harus memiliki delapan elektron valensi. Namun dalam karbokasi, hanya ada enam elektron dalam atom karbon yang memiliki muatan positif. Oleh karena itu, ia cenderung berbagi dua elektron lagi dari spesies elektronegatif. Ini membuat atom karbon stabil dan menetralkan muatan positif. Inilah alasannya reaktivitas tinggi karboksi klasik. Namun, energi karbokasi klasik rendah dibandingkan dengan energi karbokasi non -klasik yang sesuai. Tapi perbedaan dalam energi mereka sangat kecil.
Apa itu karbokasi non -klasik?
Karbokasi non-klasik adalah ion yang mengandung karbon bermuatan positif di pusat dua elektron tiga pusat. Ini berarti, ada tiga atom yang berbagi dua elektron dalam karbokasi ini. Berbagi elektron jenis ini dinamai sebagai delokalisasi elektron.

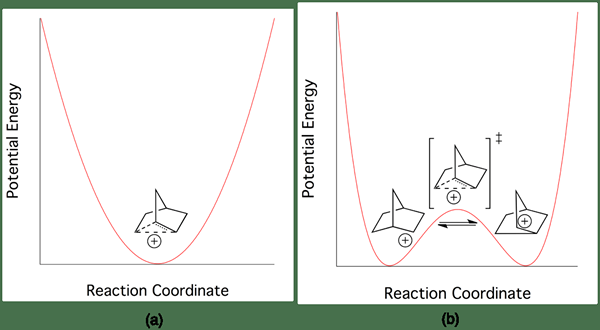
Gambar 02: Perbedaan energi antara karbokasi klasik dan non -klasik
Contoh paling umum dari karbokation non-klasik adalah kation 2-norbornyl. Itu ada dalam struktur dua elektron tiga pusat yang kurang simetris. Ada sangat sedikit perbedaan energi antara karbokasi klasik dan non -klasik. Oleh karena itu, sangat sulit untuk membedakan mereka secara eksperimental.
Apa perbedaan antara karbokasi klasik dan non -klasik?
Kami dapat mengklasifikasikan karbokasi ke dalam dua kelompok sebagai karbokasi klasik dan non -klasik, tergantung pada struktur kimianya. Perbedaan utama antara karbokasi klasik dan non-klasik adalah bahwa karbokasi klasik memiliki atom karbon yang memiliki enam elektron dalam tiga ikatan kimia, sedangkan karbokasi non-klasik memiliki struktur dua elektron tiga pusat. Energi karbokasi non -klasik lebih tinggi dari energi karbokasi klasik, tetapi perbedaan antara energi ini sangat kecil; Oleh karena itu, sangat sulit untuk membedakan perbedaan antara struktur klasik dan non -klasik.
Selain itu, energi aktivasi untuk konversi karbokasi klasik menjadi karbokasi non -klasik atau sebaliknya sangat kecil. Selain itu, karbokasi klasik memiliki muatan positif pada atom karbon dan pasangan elektron NOD di sekitar atom karbon, tetapi pada karbokasi non -klasik, elektron didelokalisasi di sekitar atom karbon. Contoh karbokation klasik adalah ion metenium, sedangkan contoh untuk karbokasi non-klasik adalah ion 2-norboryl.

Ringkasan - Karbokasi klasik vs non -klasik
Kami dapat mengklasifikasikan karbokasinya menjadi dua kelompok sebagai karbokasi klasik dan nonkals, tergantung pada struktur kimianya. Perbedaan utama antara karbokasi klasik dan non-klasik adalah bahwa karbokasi klasik memiliki atom karbon yang memiliki enam elektron dalam tiga ikatan kimia, sedangkan karbokasi non-klasik memiliki struktur dua elektron tiga pusat. Contoh karbokasi klasik adalah ion metenium sementara contoh karbokasi non-klasik adalah ion 2-norboryl.
Referensi:
1. “Karboksi.”Kimia Libretexts, 5 Juni 2019, tersedia di sini.
2. “Carbocation”. Wikipedia.Org, 2019, tersedia di sini.
Gambar milik:
1. “The Cyclopropyl Carbinyl Cation” oleh V8Rik di Inggris Wikipedia (CC BY-SA 3.0) Via Commons Wikimedia
2. “Norbornyl Cation Single Well Vs Double Well Potential” oleh JCAL730 - Pekerjaan Sendiri (Domain Publik) melalui Commons Wikimedia


