Perbedaan antara teori tabrakan dan teori keadaan transisi
Perbedaan Utama - Tabrakan Teori vs Teori Negara Transisi
Teori tabrakan dan teori keadaan transisi adalah dua teori yang digunakan untuk menjelaskan laju reaksi reaksi kimia yang berbeda pada tingkat molekuler. Teori tabrakan menggambarkan tabrakan molekul gas dalam reaksi kimia fase gas. Teori keadaan transisi menjelaskan laju reaksi dengan mengasumsikan pembentukan senyawa menengah yang merupakan keadaan transisi. Itu perbedaan utama Antara teori tabrakan dan teori keadaan transisi adalah itu Teori tabrakan berkaitan dengan tabrakan antara molekul gas sedangkan teori keadaan transisi berkaitan dengan pembentukan senyawa menengah dalam keadaan transisi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Teori Tabrakan
3. Apa itu Teori Negara Transisi
4. Perbandingan Berdampingan - Teori Tabrakan vs Teori Negara Transisi Dalam Bentuk Tabel
5. Ringkasan
Apa itu Teori Tabrakan?
Teori tabrakan menjelaskan bahwa reaksi kimia fase gas terjadi ketika molekul bertabrakan dengan energi kinetik yang cukup. Teori ini dibangun berdasarkan teori kinetik gas (teori kinetik gas menggambarkan bahwa gas mengandung partikel yang tidak memiliki volume yang ditentukan tetapi dengan massa yang ditentukan dan tidak ada atraksi antar molekul atau tolakan antara partikel -partikel gas ini).

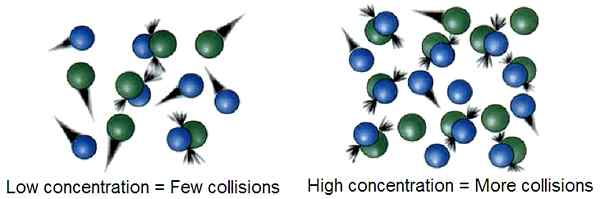
Gambar 01: Jika ada banyak partikel gas dalam volume kecil, maka konsentrasinya tinggi, maka probabilitas bertabrakan dua partikel gas tinggi. Ini menghasilkan sejumlah besar tabrakan yang berhasil
Menurut teori tabrakan, hanya beberapa tabrakan antara partikel gas yang menyebabkan partikel -partikel ini mengalami reaksi kimia yang cukup besar. Tabrakan ini dikenal sebagai tabrakan yang berhasil. Energi yang dibutuhkan untuk tabrakan yang berhasil ini dikenal sebagai energi aktivasi. Tabrakan ini dapat menyebabkan kerusakan dan pembentukan ikatan kimia.
Apa itu Teori Negara Transisi?
Teori keadaan transisi menunjukkan bahwa, di antara keadaan di mana molekul adalah reaktan dan keadaan di mana molekul adalah produk, ada keadaan yang dikenal sebagai keadaan transisi. Teori keadaan transisi dapat digunakan untuk menentukan laju reaksi reaksi dasar. Menurut teori ini, reaktan, produk dan senyawa keadaan transisi berada dalam keseimbangan kimia satu sama lain.
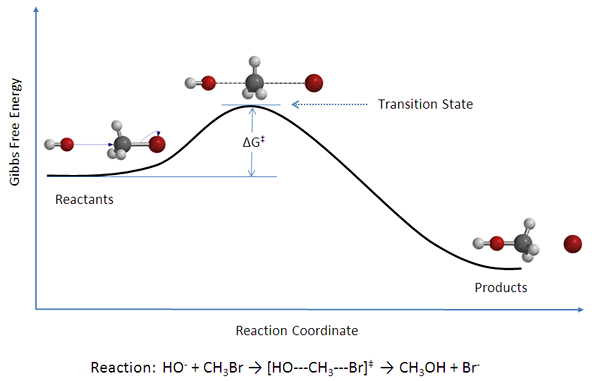
Gambar 02: Diagram yang menunjukkan reaktan, produk, dan kompleks keadaan transisi
Teori keadaan transisi dapat digunakan untuk memahami mekanisme reaksi kimia dasar. Teori ini adalah alternatif yang lebih akurat untuk Persamaan Arrhenius. Menurut teori keadaan transisi, ada tiga faktor utama yang mempengaruhi mekanisme reaksi;
- Konsentrasi senyawa keadaan transisi (dikenal sebagai kompleks aktif)
- Tingkat kerusakan kompleks yang diaktifkan - ini menentukan laju pembentukan produk yang diinginkan
- Cara kerusakan kompleks yang diaktifkan - ini menentukan produk yang terbentuk dalam reaksi kimia
Namun, menurut teori ini, ada dua pendekatan untuk reaksi kimia; Kompleks yang diaktifkan dapat kembali ke bentuk reaktan, atau dapat pecah untuk membentuk produk. Perbedaan energi antara energi reaktan dan energi keadaan transisi dikenal sebagai energi aktivasi.
Apa perbedaan antara teori tabrakan dan teori keadaan transisi?
Teori Tabrakan vs Teori Negara Transisi | |
| Teori tabrakan menjelaskan bahwa reaksi kimia fase gas terjadi ketika molekul bertabrakan dengan energi kinetik yang cukup. | Teori keadaan transisi menunjukkan bahwa, di antara keadaan di mana molekul adalah reaktan dan keadaan di mana molekul adalah produk, ada keadaan yang dikenal sebagai keadaan transisi. |
| Prinsip | |
| Teori tabrakan menyatakan bahwa reaksi kimia (dalam fase gas) terjadi karena tabrakan antara reaktan. | Teori keadaan transisi menyatakan bahwa reaksi kimia terjadi melalui melalui keadaan transisi. |
| Persyaratan | |
| Menurut teori tabrakan, hanya tabrakan yang berhasil menyebabkan reaksi kimia terjadi. | Menurut teori keadaan transisi, reaksi kimia akan berkembang jika reaktan dapat mengatasi penghalang energi aktivasi. |
Ringkasan -Tabrakan Teori vs Teori Negara Transisi
Teori tabrakan dan teori keadaan transisi digunakan untuk menjelaskan laju reaksi dan mekanisme reaksi kimia yang berbeda. Perbedaan antara teori tabrakan dan teori keadaan transisi adalah bahwa teori tabrakan berkaitan dengan tabrakan antara molekul gas sedangkan teori keadaan transisi berkaitan dengan pembentukan senyawa menengah dalam keadaan transisi.
Referensi:
1.“Teori Tabrakan.”Kimia Libretexts, Libretexts, 22 Mei 2017. Tersedia disini
2.“Teori Negara Transisi.”Wikipedia, Wikimedia Foundation, 28 Feb. 2018. Tersedia disini
3.“9.7: Teori laju reaksi.”Kimia Libretexts, Libretexts, 21 Juli 2016. Tersedia disini
Gambar milik:
1.'Molecular-Collisions'By Sadi_Carnot (Domain Publik) Via Commons Wikimedia
2.Diagram koordinat rxn 5'by chem540grp1f08 - pekerjaan sendiri, (cc by -sa 3.0) Via Commons Wikimedia


