Perbedaan antara warna yang diproduksi oleh logam alkali dan kalsium

Itu perbedaan utama antara warna yang diproduksi oleh logam alkali dan kalsium adalah bahwa Kalsium menghasilkan warna api oranye merah karakteristik yang tidak dapat dihasilkan oleh logam alkali mana pun.
Tes api adalah teknik analisis kualitatif di mana kita bisa mendapatkan ide untuk mengidentifikasi elemen kimia tertentu melalui melihat warna api yang diberikannya ketika kita membakar elemen itu; terutama logam. Namun, kami tidak dapat menggunakan teknik analitik ini untuk mengidentifikasi semua logam yang kami tahu karena beberapa logam tidak menghasilkan warna api dan beberapa logam memiliki warna api yang sama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Warna apa yang diproduksi oleh logam alkali
3. Warna apa yang dihasilkan oleh kalsium
4. Perbandingan berdampingan - warna yang diproduksi oleh alkali logam vs kalsium dalam bentuk tabel
6. Ringkasan
Warna apa yang dihasilkan oleh logam alkali?
Warna yang diproduksi oleh logam alkali bervariasi sesuai dengan logam. Logam alkali adalah elemen kimia Grup 1. Anggota kelompok ini adalah lithium, natrium, kalium, rubidium dan cesium. Untuk logam grup 1 ini, uji api adalah cara termudah mengidentifikasi logam karena mereka memberikan warna, yang berbeda satu sama lain. Sekarang mari kita pertimbangkan metode melakukan tes nyala api.
- Bersihkan kawat platinum dengan mencelupkannya ke dalam asam HCl pekat.
- Lalu pegang dengan api bunsen panas.
- Kita harus mengulangi dua langkah di atas sampai kawat platinum tidak menunjukkan warna api.
- Kemudian kelembab kawat lagi dalam asam dan celupkan ke dalam sampel logam yang akan kita uji.
- Selanjutnya, pegang kawat bersama dengan sampel di atasnya dalam pembakar bunsen panas. Ini menunjukkan warna berbeda yang merupakan warna api dari logam sampel

Gambar 01: Warna api rubidium
Ketika kami memegang logam sampel dalam nyala api, energi panas nyala menyebabkan elektron logam melompat dari satu tingkat energi ke tingkat energi yang lebih tinggi. Kami menyebutnya "eksitasi elektron". Namun, eksitasi ini sangat tidak stabil. Dengan demikian, elektron segera kembali ke tempat itu, melepaskan energi sebagai cahaya tampak. Kami mengenali ini sebagai warna api. Selain itu, warna yang diberikan oleh atom yang lebih besar sering memiliki intensitas rendah daripada atom kecil. Warna api yang diproduksi oleh logam alkali adalah sebagai berikut:
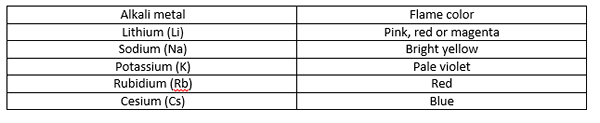
Warna apa yang dihasilkan oleh kalsium?
Tes api untuk kalsium memberikan warna oranye merah karakteristik, yang tidak dapat dihasilkan oleh logam lainnya.

Gambar 02: Warna api kalsium
Meskipun rubidium dalam kelompok logam alkali juga menghasilkan warna merah, ia berbeda dari warna kalsium terutama karena perbedaan ukuran kedua atom (rubidium memiliki satu cangkang elektron tambahan dari atom kalsium; dengan demikian eksitasi elektron berbeda dari satu sama lain. Ini menghasilkan warna api yang berbeda).
Apa perbedaan antara warna yang dihasilkan oleh logam alkali dan kalsium?
Logam alkali menghasilkan warna api yang berbeda yang membuatnya mudah untuk mengidentifikasi satu logam alkali dari yang lain. Misalnya, warna lithium - magenta, natrium - kuning cerah, kalium - violet pucat, rubidium - merah, dan cesium - biru. Namun, warna api yang diproduksi oleh kalsium berbeda dari semua warna ini; Ini menghasilkan warna oranye-merah, yang hanya merupakan warna api kalsium saja (tidak ada logam lain yang memberikan warna yang sama). Ini adalah perbedaan antara warna yang diproduksi oleh logam alkali dan kalsium.

Ringkasan -Warna yang Diproduksi oleh Alkali Logam vs Calcium
Logam yang berbeda menghasilkan warna api yang berbeda saat kita membakarnya. Warna yang dihasilkan oleh kalsium adalah karakteristik untuk kalsium; Dengan demikian, kita dapat membedakannya dari warna api yang diberikan oleh logam alkali. Perbedaan antara warna yang diproduksi oleh logam alkali dan kalsium adalah bahwa kalsium menghasilkan warna api oranye-merah yang tidak dapat diproduksi oleh salah satu logam alkali mana pun.
Referensi:
1. Helmenstine, Anne Marie. “Bagaimana warna uji api diproduksi."Thoughtco, Thoughtco. Tersedia disini
2. Libretexts. “Tes api.”Kimia Libretexts, Libretexts, 17 Feb. 2018. Tersedia disini
Gambar milik:
1."Die Flammenfärbung des Rubidium" oleh Didaktische.Medien - pekerjaan sendiri, (cc by -sa 3.0) Via Commons Wikimedia
2.”356886434" oleh Tjmwatson (CC oleh 2.0) Via Flickr


