Perbedaan antara komposisi dan stoikiometri reaksi
Itu perbedaan utama Antara komposisi dan stoikiometri reaksi adalah itu Komposisi stoikiometri mengacu pada susunan atom dari senyawa kimia, sedangkan stoikiometri reaksi mengacu pada jumlah senyawa yang dikonsumsi atau diproduksi selama reaksi kimia.
Stoikiometri adalah istilah kimia yang menggambarkan data kuantitatif tentang senyawa kimia atau reaksi kimia. Jika data ini tentang senyawa kimia, maka kami menyebutnya komposisi stoikiometri; Jika ini tentang reaksi kimia, kita bisa menyebutnya reaksi stoikiometri.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu komposisi stoikiometri
3. Apa itu reaksi stoikiometri
4. Perbandingan berdampingan - komposisi vs reaksi stoikiometri dalam bentuk tabel
5. Ringkasan
Apa itu komposisi stoikiometri?
Komposisi stoikiometri adalah analisis kuantitatif senyawa kimia mengenai komposisi atomnya. Istilah ini mengacu pada jenis atom dan jumlahnya yang ada dalam senyawa kimia tertentu. Kita dapat menentukan ini menggunakan formula kimia senyawa. Atomisitas molekul memberikan jumlah total atom yang ada dalam senyawa kimia. Tetapi itu tidak memberikan detail tentang elemen kimia yang dimiliki atom -atom senyawa dan jumlahnya. Namun demikian, kita dapat menggunakan stoikiometri komposisi senyawa tertentu untuk memprediksi formula kimia. Oleh karena itu, komposisi stoikiometri hanyalah make-up kimia dari spesies kimia.
Sebagai contoh, komposisi stoikiometri molekul glukosa diberikan sebagai enam atom karbon, dua belas atom hidrogen dan enam atom oksigen. Oleh karena itu, kita dapat menentukan bahwa satu molekul glukosa mengandung karbon, hidrogen dan atom oksigen dalam rasio 6: 12: 6. Ini adalah komposisi stoikiometri glukosa.
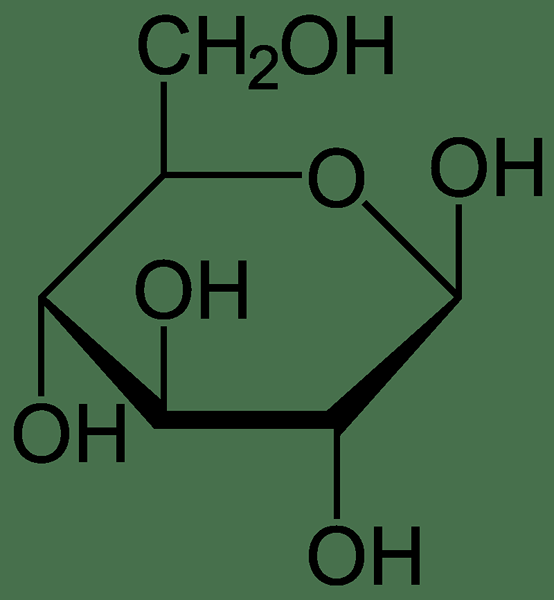
Gambar 01: Komposisi kimia molekul glukosa
Ada berbagai cara untuk menentukan stoikiometri komposisi dari senyawa yang tidak diketahui. Sampel senyawa yang tidak diketahui dapat digunakan untuk menentukan jenis elemen kimia dalam sampel tersebut bersama dengan massa masing -masing elemen. Maka jumlah mol dari masing -masing elemen per sampel dapat dihitung menggunakan massa ini. Nilai molar dapat dibulatkan untuk mendapatkan rasio yang paling mungkin antara berbagai jenis atom dalam sampel untuk memprediksi rumus molekuler.
Apa itu reaksi stoikiometri?
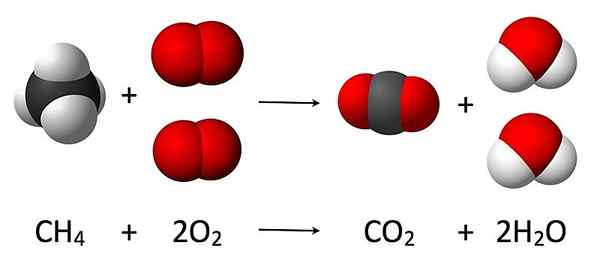
Reaksi stoikiometri adalah rasio antara reaktan dan produk dari reaksi kimia tertentu. Fenomena ini sangat penting dalam menyeimbangkan reaksi kimia untuk mendapatkan hubungan antara reaktan dan berapa banyak produk yang bisa kita dapatkan dari bereaksi spesies tersebut.

Gambar 02: Contoh untuk reaksi stoikiometri
Konsep stoikiometri reaksi didasarkan pada hukum konservasi massa, yang menunjukkan bahwa massa total reaktan harus sama dengan massa total produk karena massa tidak dapat dibuat atau dihancurkan, hanya dapat dikonversi menjadi bentuk lain, seperti halnya energi.
Mari kita pertimbangkan contoh untuk memahami teori di balik stoikiometri reaksi. Reaksi antara logam alkali dan air menghasilkan energi panas, hidroksida logam, dan gas hidrogen. Di sini, detail yang kita tahu adalah massa logam alkali yang digunakan dan jumlah air yang digunakan untuk reaksi. Setelah selesainya reaksi, jumlah gas hidrogen dapat dikumpulkan dan menggunakan volumenya, mol gas hidrogen yang dikembangkan dapat dihitung. Oleh karena itu, dengan asumsi bahwa semua logam alkali bereaksi dengan air, kita bisa mendapatkan rasio antara reaktan dan produk yang terlibat dalam reaksi ini. Ini adalah reaksi stoikiometri logam alkali dalam reaksi air.
Apa perbedaan antara komposisi dan stoikiometri reaksi?
Perbedaan utama antara komposisi dan stoikiometri reaksi adalah bahwa stoikiometri komposisi mengacu pada susunan atom dari senyawa kimia, sedangkan stoikiometri reaksi mengacu pada jumlah senyawa yang dikonsumsi atau diproduksi selama reaksi kimia. Sementara komposisi stoikiometri memberikan rasio antara atom dari masing -masing elemen kimia yang ada dalam senyawa, stoikiometri reaksi memberikan rasio antara reaktan dan produk yang terlibat dalam reaksi tertentu.
Di bawah infografis merangkum perbedaan antara komposisi dan stoikiometri reaksi.

Ringkasan -Komposisi vs Reaksi Stoikiometri
Stoikiometri adalah metode analisis kuantitatif senyawa kimia atau reaksi kimia. Perbedaan utama antara komposisi dan stoikiometri reaksi adalah bahwa stoikiometri komposisi mengacu pada susunan atom dari senyawa kimia, sedangkan stoikiometri reaksi mengacu pada jumlah senyawa yang dikonsumsi atau diproduksi selama reaksi kimia.
Referensi:
1. “Reaksi stoikiometri dan penyeimbang." Libreteks Kimia, Libretexts, 25 September. 2019, tersedia di sini.
Gambar milik:
1. "Beta-D-Glucopyranose" oleh Neurotiker-karya sendiri (domain publik) melalui Commons Wikimedia
2. "Reaksi Pembakaran Metana" oleh Jyntorobert a. Rohdejacek fhjynto - (domain publik) via commons wikimedia


