Perbedaan antara reaksi bersama dan bertahap
Itu perbedaan utama antara reaksi terpadu dan bertahap adalah itu Reaksi terpadu adalah reaksi satu langkah, sedangkan reaksi bertahap adalah reaksi multistep.
Istilah -istilah yang terpadu dan bertahap reaksi berada di bawah bidang kimia fisik di mana laju reaksi ditentukan dengan menggunakan perubahan dalam jumlah reaktan dan produk dengan waktu. Semua reaksi kimia yang kita tahu dapat dikategorikan ke dalam dua kelompok yang berbeda sebagai reaksi bersama dan reaksi bertahap tergantung pada mekanisme reaksi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa reaksi bersama
3. Apa reaksi bertahap
4. Perbandingan berdampingan - reaksi bersama vs bertahap dalam bentuk tabel
5. Ringkasan
Apa reaksi bersama?
Reaksi bersama adalah reaksi kimia yang hanya melibatkan satu langkah. Itu berarti; Semua reaksi satu langkah termasuk dalam kategori reaksi bersama. Oleh karena itu, pemecahan ikatan dan reaksi pembentukan ikatan terjadi secara bersamaan untuk membentuk produk. Dengan kata lain, tidak ada perantara reaktif atau kompleks energi tinggi yang tidak stabil yang terbentuk selama jenis reaksi kimia ini.
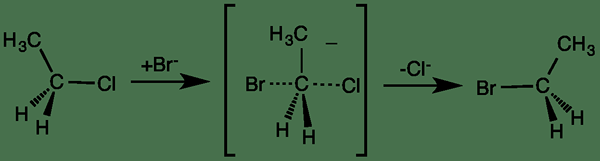
Gambar 01: Contoh reaksi bersama (berisi perantara yang tidak stabil)
Secara umum, reaksi bersama tidak tergantung pada polaritas pelarut, dan mekanisme reaksi dinamai sebagai mekanisme bersama. Beberapa contoh umum untuk jenis reaksi ini termasuk reaksi periklik, reaksi SN2 dan beberapa reaksi penataan ulang seperti penataan ulang claisen.
Apa reaksi bertahap?
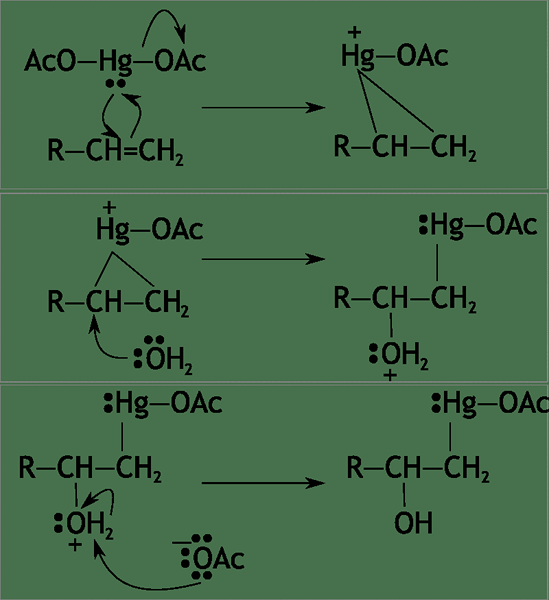
Reaksi bertahap adalah reaksi beberapa langkah. Oleh karena itu, ada atau lebih perantara kimia dalam reaksi ini. Zat antara ini biasanya sangat reaktif karena energi tinggi yang membuatnya tidak stabil. Reaksi bertahap biasanya mengandung dua atau lebih reaksi dasar.

Gambar 02: Contoh reaksi bertahap
Berbeda dengan reaksi bertahap, pemecahan ikatan dan pembentukan ikatan dalam reaksi bertahap terjadi pada langkah yang berbeda (tidak dalam satu langkah). Oleh karena itu, reaktan tidak dapat dikonversi menjadi produk secara langsung. "Reaksi keseluruhan" dalam reaksi bertahap yang memberikan konversi reaktan menjadi produk. Kita bisa mendapatkan reaksi keseluruhan dengan secara akurat menyeimbangkan semua langkah dalam reaksi bertahap. Namun demikian, ada satu reaksi dasar dalam reaksi bertahap yang menentukan laju reaksi. Ini adalah reaksi paling lambat dari seri reaksi, dan mungkin atau mungkin tidak memiliki reaktan atau produk yang terlibat (mungkin hanya mengandung perantara reaksi).
Apa perbedaan antara reaksi bersama dan bertahap?
Istilah -istilah yang terpadu dan bertahap reaksi berada di bawah bidang kimia fisik di mana laju reaksi ditentukan dengan menggunakan perubahan dalam jumlah reaktan dan produk dengan waktu. Perbedaan utama antara reaksi bersama dan bertahap adalah bahwa reaksi terpadu adalah reaksi langkah tunggal, sedangkan reaksi bertahap adalah reaksi multistep. Langkah penentu laju dari reaksi terpadu itu sendiri merupakan reaksi bersama. Tetapi, dalam reaksi bertahap, reaksi dasar yang paling lambat adalah langkah penentu laju.
Selain itu, tidak ada intermediet reaksi dalam reaksi bersama karena reaktan secara langsung dikonversi menjadi produk. Namun, dalam reaksi bertahap, ada satu atau lebih senyawa menengah yang sangat tidak stabil karena tingkat energi yang tinggi dari senyawa. Reaksi keseluruhan dari reaksi bertahap memberikan konversi reaktan menjadi produk.
Infografis di bawah ini memberikan rincian lebih lanjut tentang perbedaan antara reaksi bersama dan bertahap.
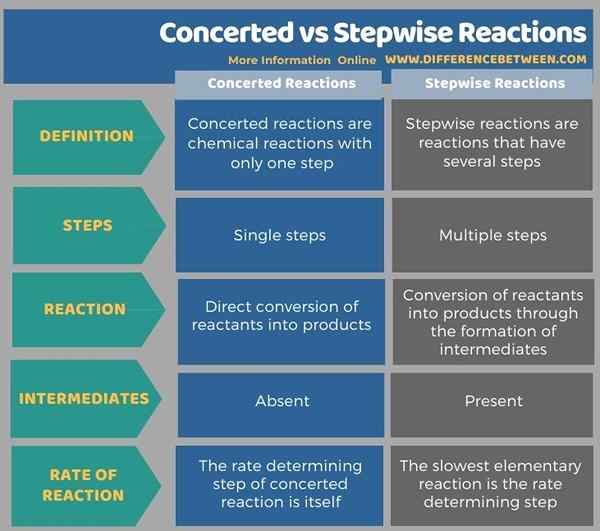
Ringkasan -Reaksi Bertahap Vs Bertahap
Semua reaksi kimia yang kita tahu dapat dikategorikan ke dalam dua kelompok sebagai reaksi bersama dan reaksi bertahap. Perbedaan utama antara reaksi bersama dan bertahap adalah bahwa reaksi terpadu adalah reaksi langkah tunggal, sedangkan reaksi bertahap adalah reaksi multistep.
Referensi:
1. “Reaksi bersama.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
2. “Reaksi bersama.”Wikipedia, Wikimedia Foundation, 2 Juni 2017, tersedia di sini.
Gambar milik:
1. “Sn2etcl+Bromide” oleh Smokefoot - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia
2. “Oxymercuration Stepwise” oleh TheJackal di Wikipedia Inggris - ditransfer dari EN.Wikipedia ke Commons oleh Ronhjones menggunakan CommonShelper (Public Domain) via Commons Wikimedia