Perbedaan antara disosiasi dan solvasi
Itu perbedaan utama antara disosiasi dan solvasi adalah itu Disosiasi adalah pemecahan zat ke dalam atom atau ion dari mana zat dibuat sedangkan solvasi adalah pembubaran zat dalam suatu pelarut karena gaya tarik antara molekul pelarut dan komponen zat tersebut.
Disosiasi dan solvasi sering ditemukan dalam kimia analitik dan dalam kimia anorganik, mengenai kerusakan zat kimia pada interaksi yang berbeda antara atom dan ion dalam suatu zat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu disosiasi
3. Apa itu solvasi
4. Perbandingan berdampingan - disosiasi vs solvasi dalam bentuk tabel
5. Ringkasan
Apa itu disosiasi?
Istilah disosiasi mengacu pada kerusakan atau pemisahan senyawa menjadi partikel yang lebih kecil. Proses disosiasi membentuk produk yang bermuatan elektrik atau netral. Itu berarti; Produk disosiasi dapat berupa ionik atau non-ionik. Namun, ini tidak melibatkan gain atau kehilangan elektron oleh atom.
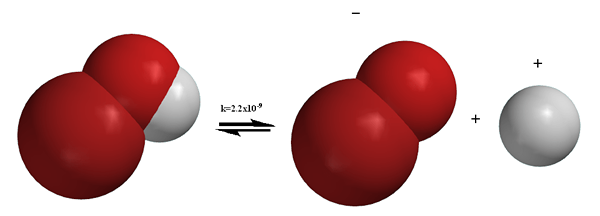
Gambar 01: Disosiasi Molekul BROH
Berbeda dengan proses ionisasi, disosiasi melibatkan pemisahan ion yang sudah ada dalam suatu senyawa. Terkadang, disosiasi juga dapat menghasilkan partikel netral untuk contoh, kerusakan N2HAI4 Hasil dalam produksi dua molekul NO2. Proses disosiasi dapat dibalikkan sebagian besar waktu. Itu berarti, ion yang terpisah dapat diatur ulang untuk menghasilkan senyawa sebelumnya. Misalnya, seperti yang disebutkan di atas, pelarutan NaCl adalah proses disosiasi, dan menghasilkan dua partikel bermuatan. Tapi, NaCl padat dapat diperoleh lagi dengan kondisi yang tepat, yang membuktikan bahwa disosiasi dapat dibalikkan. Tidak seperti ionisasi, disosiasi terjadi dalam senyawa ionik.
Apa itu solvasi?
Solvasi adalah pembubaran suatu zat dalam pelarut tertentu. Solvasi terjadi karena gaya tarik antara molekul pelarut dan molekul zat terlarut. Biasanya, gaya tarik yang terlibat dalam proses ini adalah ikatan ion-dipol dan atraksi ikatan hidrogen. Kekuatan daya tarik ini menyebabkan pembubaran zat terlarut dalam pelarut.

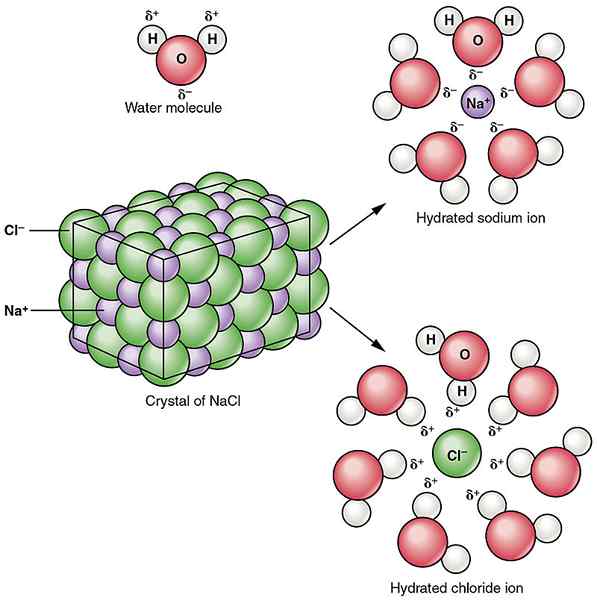
Gambar 02: Solvasi senyawa ionik natrium klorida dalam air
Interaksi ion-dipol dapat ditemukan antara senyawa ionik dan pelarut kutub. E.G. Air adalah pelarut kutub. Saat natrium klorida ditambahkan ke dalam air, molekul air kutub menarik ion natrium dan ion klorida secara terpisah, yang menyebabkan ion natrium dan klorida pecah. Ini menghasilkan kerusakan senyawa ionik natrium klorida.
Apa perbedaan antara disosiasi dan solvasi?
Disosiasi dan solvasi adalah istilah yang menggambarkan bagaimana zat yang berbeda dipecah menjadi potongan -potongan kecil atau atom/ion tergantung pada interaksi. Perbedaan utama antara disosiasi dan solvasi adalah bahwa disosiasi adalah pemecahan zat ke dalam atom atau ion dari mana zat tersebut dibuat sedangkan solvasi adalah pembubaran zat dalam pelarut karena gaya tarik antara molekul pelarut dan komponen zat tersebut.
Tabulasi di bawah ini menunjukkan lebih banyak perbedaan antara disosiasi dan solvasi.
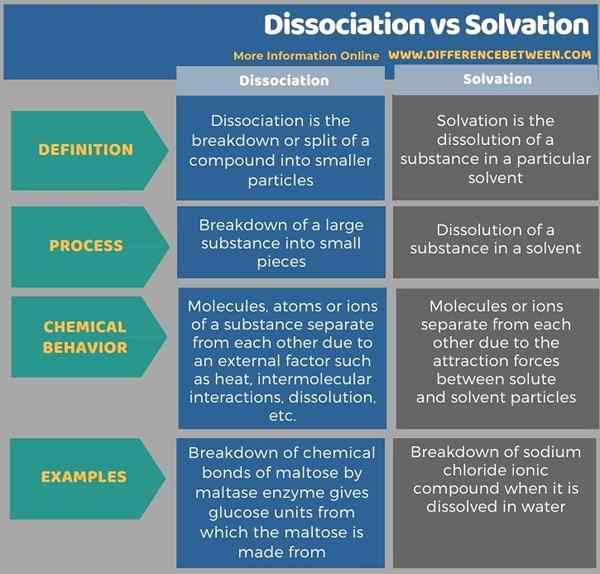
Ringkasan -Disosiasi vs Solvasi
Perbedaan utama antara disosiasi dan solvasi adalah bahwa disosiasi adalah pemecahan zat ke dalam atom atau ion dari mana zat tersebut dibuat sedangkan solvasi adalah pembubaran zat dalam pelarut karena gaya tarik antara molekul pelarut dan komponen zat tersebut.
Referensi:
1. “Solusi, solvasi, dan disosiasi.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
2. “Solvasi dan disosiasi.”Sokrates.org, tersedia di sini.
Gambar milik:
1. “Disosiasi Asam BROH” oleh Achow801 - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “214 Disosiasi Sodium Klorida dalam Air -01” oleh OpenStax College - Anatomy & Physiology, Situs Web Connexions, 19 Jun 2013 (CC oleh 3.0) Via Commons Wikimedia


