Perbedaan antara titik kritis dan triple point
Perbedaan Utama - Titik Kritis VS Triple Titik
Titik kritis dan titik tiga adalah istilah yang digunakan untuk menjelaskan suhu dan tekanan di mana dua atau lebih fase zat dapat hidup berdampingan satu sama lain. Titik kritisnya adalah kondisi di mana fase cairan dan uap dari zat yang sama hidup berdampingan. Titik tiga adalah kondisi di mana ketiga fase materi dapat hidup berdampingan satu sama lain. Itu perbedaan utama antara titik kritis dan titik tiga adalah itu Titik kritis menggambarkan koeksistensi dua fase zat yang sama sedangkan triple point menggambarkan koeksistensi tiga fase dari zat yang sama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa titik kritis
3. Apa itu Triple Point
4. Kesamaan antara titik kritis dan triple point
5. Perbandingan berdampingan - titik kritis vs triple point dalam bentuk tabel
6. Ringkasan
Apa titik kritis?
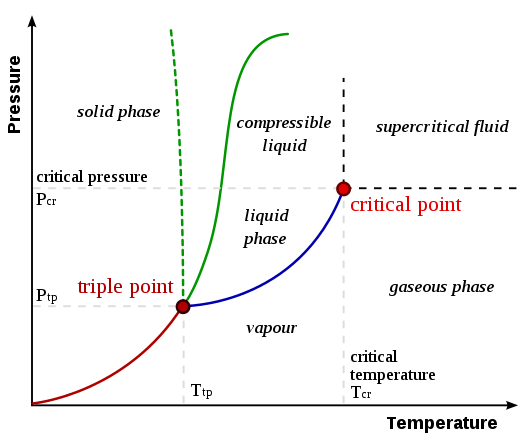
Titik kritis suatu zat adalah titik akhir dari kurva kesetimbangan fase zat itu. Kurva kesetimbangan fase atau diagram fase adalah grafik tekanan versus suhu di mana perubahan fase zat ditampilkan. Ini menunjukkan suhu dan tekanan di mana zat tersebut ada sebagai padatan, cair atau gas. Titik kritisnya adalah suhu dan tekanan di mana fase cairan dan uap hidup berdampingan.

Gambar 01: Diagram fase menunjukkan titik kritis dan titik tiga
Suhu dan tekanan pada titik kritis dinamai sebagai suhu kritis (TC) dan tekanan kritis (PC). Seperti yang ditunjukkan pada gambar di atas, garis antara dua fase dikenal sebagai batas. Titik kritis menunjukkan titik di mana batas garis lenyap.
Mengetahui titik kritis suatu zat terkadang sangat penting. Misalnya, gas tidak akan pernah bisa kental pada suhu dan tekanan di atas titik kritisnya. Ini karena kekuatan antarmolekul antara molekul gas melemah pada suhu yang sangat tinggi karena energi kinetik molekul tersebut meningkat.
Ada dua jenis titik kritis;
-
Titik kritis Liquid-Vapour
Ini adalah titik kritis yang khas di mana uap suatu zat hidup berdampingan dengan bentuk cairnya. Titik kritis air adalah pada 647 K dan 22.064 MPa.
-
Titik kritis cair-cair
Jenis titik kritis ini didefinisikan untuk solusi. Itu adalah suhu dan tekanan di mana campuran larutan dipisahkan menjadi dua fase cair yang berbeda.
Apa itu Triple Point?
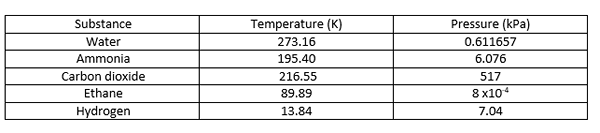
Titik tiga adalah suhu dan tekanan di mana fase padat, cair, dan uap dari zat tertentu hidup berdampingan dalam kesetimbangan. Ini menggambarkan keadaan termodinamika spesifik matte. Terkadang, titik tiga mungkin melibatkan lebih dari satu fase padat ketika ada polimorf zat yang ada. Dalam diagram fase, titik tiga adalah titik di mana ketiga garis batas bertemu satu sama lain. Beberapa contoh titik tiga diberikan di bawah ini.
Apa kesamaan antara titik kritis dan titik tiga?
- Titik kritis dan titik tiga menggambarkan suhu dan tekanan spesifik tertentu.
- Titik kritis dan titik tiga menggambarkan keadaan keseimbangan di mana dua atau lebih keadaan fisik suatu zat hidup berdampingan.
Apa perbedaan antara titik kritis dan titik tiga?
Titik kritis vs triple point | |
| Titik kritis suatu zat adalah titik akhir dari kurva kesetimbangan fase zat itu. | Titik tiga adalah suhu dan tekanan di mana fase padat, cair, dan uap dari zat tertentu hidup berdampingan dalam kesetimbangan. |
| Fase | |
| Titik kritis menggambarkan koeksistensi dua fase dari zat yang sama. | Triple Point menggambarkan koeksistensi tiga fase dari zat yang sama. |
| Air sebagai contoh | |
| Titik kritis air adalah pada 647 K dan 22.064 MPa. | Titik air triple berada di 273.16 K dan 0.611657 MPa. |
| Diagram fase | |
| Titik kritis adalah titik akhir dari kurva diagram fase. | Triple point adalah titik di mana semua garis batas bertemu satu sama lain. |
Ringkasan - Titik Kritis vs Triple Titik
Titik kritis suatu zat adalah titik akhir dari kurva kesetimbangan fase zat itu yang memberikan suhu dan tekanan di mana fase cair dan uap suatu zat dapat hidup berdampingan satu sama lain. Titik tiga memberikan suhu dan tekanan di mana ketiga fase materi dapat hidup berdampingan satu sama lain. Perbedaan antara titik kritis dan titik tiga adalah bahwa titik kritis menggambarkan koeksistensi dua fase zat yang sama sedangkan triple point menggambarkan koeksistensi tiga fase dari zat yang sama.
Referensi:
1.Helmenstine, Anne Marie, D. “Definisi dan contoh triple point (kimia)."Thoughtco, Nov. 10, 2017. Tersedia disini
2."Tiga poin.”Wikipedia, Wikimedia Foundation, 6 Mar. 2018. Tersedia disini
3."Titik kritis.”Kimia Libretexts, Libretexts, 21 Juli 2016. Tersedia disini
Gambar milik:
1.'Fase-diag2' oleh Matthieumarechal, (CC BY-SA 3.0) Via Commons Wikimedia