Perbedaan antara dehidrasi oleh H2SO4 dan H3PO4
Itu perbedaan utama Antara dehidrasi oleh H2SO4 dan H3PO4 adalah itu Dehidrasi oleh H2SO4 kurang aman dan memfasilitasi reaksi yang kompleks, sedangkan dehidrasi oleh H3PO4 lebih aman dan memfasilitasi reaksi yang kurang kompleks.
Dehidrasi pada dasarnya adalah penghapusan H2O. Dehidrasi etanol dan alkohol lainnya dapat dilakukan dengan menggunakan dua katalis asam yang berbeda: asam sulfat (H2SO4) dan asam fosfat (V) (H3PO4). Dalam proses ini, etanol mengalami dehidrasi untuk mendapatkan produk alkena.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa dehidrasi oleh h2so4
3. Apa dehidrasi oleh h3po4
4. Perbandingan berdampingan - Dehidrasi oleh H2SO4 vs H3PO4 dalam bentuk tabel
5. Ringkasan
Apa dehidrasi oleh h2so4?
Dehidrasi oleh H2SO4 adalah proses kimia yang berguna dalam membentuk alkena dari alkohol menggunakan asam sulfat sebagai katalis asam. Oleh karena itu, reaksi ini termasuk pembentukan senyawa tak jenuh dari senyawa jenuh. Dengan kata lain, reaktan reaksi ini hanya memiliki ikatan tunggal, sedangkan produk dari reaksi ini memiliki ikatan tunggal dan rangkap.
Asam sulfat adalah katalis asam untuk dehidrasi alkohol. Dalam proses ini, kita harus menggunakan asam sulfat pekat. Namun, menggunakan katalis asam ini memberikan hasil yang agak berantakan. Itu karena asam sulfat adalah zat pengoksidasi yang sangat kuat, dan dapat mengurangi beberapa alkohol untuk memberikan gas karbon dioksida dan mengurangi dirinya sendiri untuk menghasilkan gas sulfur dioksida. Oleh karena itu, kedua gas ini terjadi sebagai kontaminan dalam produk akhir dan harus dihapus. Selain itu, ada beberapa reaksi lain juga; Misalnya, asam sulfat bereaksi dengan alkohol untuk memberikan massa karbon.
Dalam proses dehidrasi, alkohol dipanaskan dengan asam sulfat dalam keadaan terkonsentrasi. Di sini, jumlah asam sulfat yang berlebihan harus digunakan untuk memastikan semua alkohol bereaksi dengan asam. Larutan natrium hidroksida dapat digunakan untuk menghilangkan gas yang tidak diinginkan yang diproduksi dalam reaksi ini.
Apa dehidrasi oleh h3po4?
Dehidrasi oleh H3PO4 adalah proses kimia yang berguna dalam membentuk alkena dari alkohol menggunakan asam fosfat (V) sebagai katalis asam. Oleh karena itu, reaksi ini termasuk pembentukan senyawa tak jenuh dari senyawa jenuh. Dengan kata lain, reaktan reaksi ini hanya memiliki ikatan tunggal, sedangkan produk dari reaksi ini memiliki ikatan tunggal dan rangkap.
Gambar 02: Reaksi Dehidrasi
Mirip dengan metode yang dibahas di atas, metode ini juga membutuhkan katalis asam dalam keadaan terkonsentrasi. Kita juga perlu menggunakan asam fosfat (V) dalam jumlah berlebihan untuk memastikan semua molekul alkohol bereaksi dengan katalis asam untuk memberikan alkene yang diinginkan. Selain itu, dehidrasi menggunakan asam fosfat digunakan terutama dalam produksi alkena keadaan cair. Keuntungan utama dari reaksi ini dibandingkan dehidrasi oleh asam sulfat adalah bahwa reaksi ini tidak memberikan hasil yang berantakan dan relatif aman (tidak ada produk berbahaya yang diproduksi, e.G. Sulfur dioksida diproduksi saat menggunakan asam sulfat sebagai katalis asam adalah produk berbahaya).
Apa perbedaan antara dehidrasi oleh H2SO4 dan H3PO4?
Dehidrasi oleh H2SO4 adalah proses kimia yang berguna dalam membentuk alkena dari alkohol menggunakan asam sulfat sebagai katalis asam. Dehidrasi oleh H3PO4 adalah proses kimia yang berguna dalam membentuk alkena dari alkohol menggunakan asam fosfat (V) sebagai katalis asam. Perbedaan utama antara dehidrasi oleh H2SO4 dan H3PO4 adalah bahwa dehidrasi oleh H2SO4 kurang aman dan memfasilitasi reaksi yang kompleks, sedangkan dehidrasi oleh H3PO4 lebih aman dan memfasilitasi reaksi yang kurang kompleks.
Di bawah ini infografis tabulasi lebih banyak perbandingan untuk membedakan perbedaan antara dehidrasi oleh H2SO4 dan H3PO4.

Ringkasan -Dehidrasi oleh H2SO4 vs H3PO4
Dehidrasi etanol dan alkohol lainnya dapat dilakukan dengan menggunakan dua katalis asam yang berbeda; asam sulfat dan asam fosfat (V). Perbedaan utama antara dehidrasi oleh H2SO4 dan H3PO4 adalah bahwa dehidrasi oleh H2SO4 kurang aman dan memfasilitasi reaksi yang kompleks, sedangkan dehidrasi oleh H3PO4 lebih aman dan memfasilitasi reaksi yang kurang kompleks.
Gambar milik:
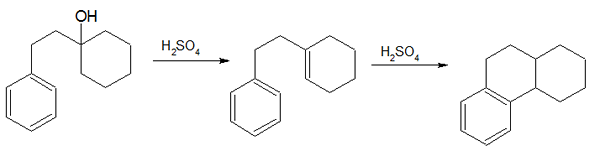
1. “Sintesis Bogert -Cook” oleh Mephisto Spa - Karya Sendiri (Domain Publik) Via Commons Wikimedia
2. “Dianhydride ethylenetetracarboxylic melalui dehidrasi asam” oleh Dmacks (bicara) - pekerjaan sendiri (domain publik) melalui commons wikimedia


