Perbedaan antara Deuteron dan Triton
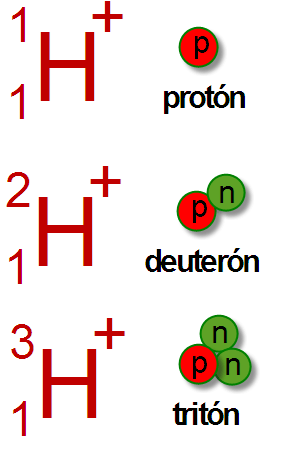
Itu perbedaan utama Antara Deuteron dan Triton adalah itu Deuteron adalah inti atom deuterium, sedangkan Triton adalah inti atom tritium.
Elemen kimia hidrogen memiliki tiga isotop utama. Mereka adalah protium, deuterium dan tritium. Ketiga isotop ini berbeda satu sama lain tergantung pada jumlah neutron dalam inti mereka. Tritium memiliki dua neutron dalam nukleusnya sementara deuterium hanya memiliki satu neutron di dalam nukleusnya.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Deuteron
3. Apa itu Triton
4. Perbandingan berdampingan - Deuteron vs Triton dalam bentuk tabel
5. Ringkasan
Apa itu Deuteron?
Deuteron adalah inti deuterium. Deuterium adalah isotop hidrogen yang memiliki proton, neutron dan elektron. Tidak seperti Protium, isotop ini memiliki proton dan neutron bersama -sama dalam inti atom. Oleh karena itu, massa atom isotop ini adalah 2. Itulah sebabnya kita bisa menyebutkannya sebagai hidrogen-2 atau 2H. Deuterium juga merupakan isotop hidrogen yang stabil. Namun, itu tidak berlimpah dibandingkan dengan protium. Kelimpahannya bervariasi antara 0.0026-0.0184%. Tidak seperti Tritium, deuterium bukan radioaktif. Itu juga tidak menunjukkan toksisitas.

Gambar 01: Isotop hidrogen yang berbeda; Nama inti isotop hidrogen
Air biasanya mengandung hidrogen-1 yang dikombinasikan dengan atom oksigen. Tapi, air juga dapat terbentuk dengan kombinasi hidrogen-2 dan oksigen. Ini adalah air yang berat. Formula kimia untuk air berat adalah D2O dimana d adalah deuterium dan o adalah oksigen. Selain itu, kita dapat menggunakan deuterium dan senyawanya dalam percobaan kimianya. Misalnya, mereka berguna sebagai label non-radioaktif dalam percobaan seperti pelarut yang digunakan dalam spektroskopi NMR. Selain itu, kita dapat menggunakan air berat sebagai moderator neutron dan pendingin untuk reaktor nuklir. Deuterium juga merupakan bahan bakar untuk fisi nuklir yang dilakukan dalam skala komersial.
Apa itu Triton
Triton adalah inti tritium. Tritium adalah isotop hidrogen yang jumlah massanya tiga. Oleh karena itu, inti tritium memiliki satu proton dan dua neutron. Itu hanya ada dalam jumlah jejak di alam karena radioaktivitasnya. Karena alasan ini, itu harus diproduksi secara artifisial untuk penggunaan praktis.
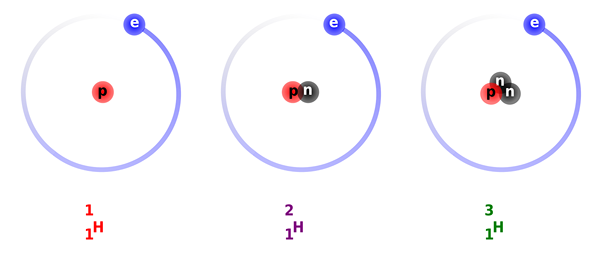
Gambar 02: Isotop hidrogen
Tritium adalah isotop radioaktif (ini adalah satu -satunya isotop radioaktif hidrogen). Ini memiliki waktu paruh 12 tahun, dan meluruh dengan memancarkan partikel beta untuk menghasilkan helium-3. Massa atom isotop ini adalah 3.0160492. Selain itu, itu ada sebagai gas (HT) pada suhu dan tekanan standar. Ini juga dapat membentuk oksida (HTO), yang kami sebut “air trisied.”Tritium berguna dalam membuat senjata nuklir dan sebagai pelacak dalam studi biologis dan lingkungan.
Apa perbedaan antara Deuteron dan Triton?
Perbedaan utama antara Deuteron dan Triton adalah bahwa Deuteron adalah inti deuterium, sedangkan Triton adalah inti tritium. Dalam hal ini, deuterium dan tritium adalah dua dari tiga isotop hidrogen.
Selain itu, perbedaan lain antara Deuteron dan Triton adalah bahwa Deuteron adalah non-radioaktif sementara Triton bersifat radioaktif. Juga, Deuteron memiliki dua komponen (proton dan neutron), sedangkan Triton memiliki tiga komponen (proton dan dua neutron).

Ringkasan -Deuteron vs Triton
Hidrogen memiliki tiga isotop utama: protium, deuterium dan tritium. Ketiga isotop ini berbeda satu sama lain tergantung pada jumlah neutron dalam inti mereka. Perbedaan utama antara Deuteron dan Triton adalah bahwa Deuteron adalah inti deuterium, sedangkan Triton adalah inti tritium.
Referensi:
1. Helmenstine, Anne Marie. “Fakta Deuterium."Thoughtco, Feb. 11, 2020, tersedia di sini.
2. Helmenstine, Anne Marie. “10 Fakta Menarik tentang Tritium Radioaktif."Thoughtco, Feb. 11, 2020, tersedia di sini.
Gambar milik:
1. "Hidron-Hydron" oleh Armando-Martin-Karya Sendiri (CC BY-SA 4.0) Via Commons Wikimedia
2. “Hidrogen deuterium tritium nuclei skematik” oleh Derivative Work: Uvainio (Talk) (CC BY-SA 3.0) Via Commons Wikimedia


